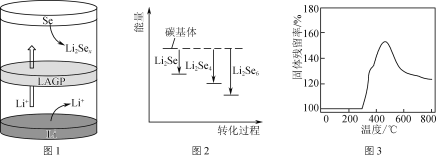
题目内容
【题目】已知:CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=﹣190kJ/mol。下列说法正确的是
O2(g)=CO2(g)+2H2(g) ΔH=﹣190kJ/mol。下列说法正确的是
A.CH3OH的燃烧热为190kJ/mol
B.该反应说明CH3OH比H2稳定
C.反应中的能量变化与反应体系的温度和压强无关
D.CO2(g)+2H2(g)=CH3OH(g)+![]() O2(g) ΔH=+190kJ/mol
O2(g) ΔH=+190kJ/mol
【答案】D
【解析】
A.燃烧热是1mol可燃物完全燃烧产生稳定的氧化物时放出的热量,反应生成氢气,未生成稳定氧化物,因此不属于甲醇的燃烧热,A错误;
B.反应是放热反应,说明甲醇和氧气能量之和大于二氧化碳和氢气能量之和,但不能证明CH3OH比H2稳定,B错误;
C.题干未注明温度和压强时,指的是25℃、101kPa条件下的反应焓变,反应中的能量变化与反应体系的温度和压强有关,C错误;
D.依据题干热化学方程式,热化学方程式改变方向,焓变改变符号,D正确;
答案选D。

 名校课堂系列答案
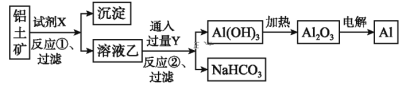
名校课堂系列答案【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体,某研究小组以氢氧化钠固体、浓氨水、干冰等为原料制备氨基甲酸铵的实验装置如图所示,其主要反应的原理为2NH3(g)+CO2(g)NH2COONH4(s) ΔH<0。
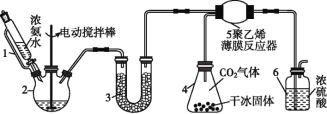
(1)仪器3中盛装的固体是____,其作用是________________。
(2)仪器6的一个作用是控制原料气按化学计量数充分反应,若反应初期观察到装置内浓硫酸中产生气泡,则应该___(填“加快”“减慢”或“不改变” )产生氨的速率。
(3)另一种制备氨基甲酸铵的反应装置(液态石蜡和CCl4均充当惰性介质)如图所示。
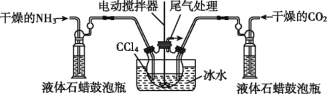
①液态石蜡鼓泡瓶的作用是________________________。
②当CCl4液体中产生较多晶体悬浮物时,立即停止反应,过滤分离得到粗产品,为了将所得粗产品干燥,可采取的方法是___(填字母)。
A.蒸馏 B.真空微热烘干 C.高压加热烘干
(4)制得的氨基甲酸铵中可能含有碳酸氢铵、碳酸铵中的一种或两种杂质(不考虑氨基甲酸铵与水的反应)。
①设计方案进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
实验步骤 | 预期现象和结论 |
步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解 | 得到无色溶液 |
步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,则证明固体中不含碳酸铵 |
步骤3:向试管中继续加入____________ | _____________,则证明固体中含有碳酸氢铵 |
②根据①的结论,取15.8 g氨基甲酸铵样品,用足量氢氧化钡溶液充分处理后,过滤洗涤、干燥,测得沉淀的质量为1.97 g。则样品中氨基甲酸铵的质量分数为____。