题目内容
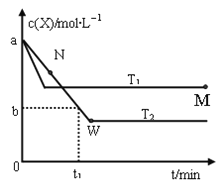
【题目】室温时,向20 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生,且混合溶液的体积可看成混合前两溶液的体积之和),下列说法不正确的是:
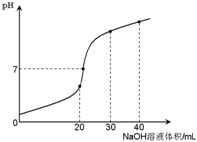
A. pH=7时,溶液中c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
B. 当V(NaOH)=20mL时,溶液中水的电离程度比纯水大
C. 当V(NaOH)=30mL时,溶液中 c(SO42-)+ c(H+)= c(NH3·H2O) + c(OH-)
D. 滴加NaOH溶液从30mL至40mL,溶液中Na+与SO42-浓度之和始终为0.1 mol·L-1
【答案】C
【解析】试题分析:A、溶液中存在物料守恒:c(SO42-)=c(NH4+)+ c(NH3·H2O),电荷守恒:c(Na+)+c(NH4+)+c(H+)= c(OH-)+ 2c(SO42-),PH=7时,c(H+)= c(OH-),则c(Na+)+c(NH4+)=2c(SO42-),由于c(SO42-)>c(NH4+),则c(Na+)>c(SO42-),所以溶液中c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),A正确;B、当V(NaOH)=20mL时,生成硫酸铵和硫酸钠,铵根离子会发生水解,促进水的电离,则溶液中水的电离程度比纯水大,B正确;C、当V(NaOH)=30mL时,3c(SO42-)="2" c(Na+),根据电荷守恒:c(Na+)+c(NH4+)+c(H+)= c(OH-)+ 2c(SO42-),物料守恒:c(SO42-)=c(NH4+)+ c(NH3·H2O),整理得c(SO42-)+2 c(H+)=2c(NH3·H2O) + 2c(OH-),C错误;D、假设滴加NaOH溶液vml,c(Na+)+c(SO42-)=(0.1×20+0.1×v)/(20+v)=0.1mol/L,D正确。答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案