题目内容
【题目】浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )
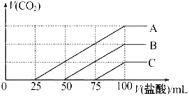
A.原NaOH溶液的浓度为0.2mol/L
B.B烧杯中通入的CO2体积为448mL
C.通入CO2后,不能确定A烧杯中的溶质
D.通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH):n(Na2CO3)=2:1
【答案】AD
【解析】
A选项,根据消耗100 mL盐酸,即盐酸的物质的量为0.02 mol,根据原子守恒可知氢氧化钠的物质的量为0.02 mol,则NaOH溶液的浓度为0.2mol/L,故A正确;
B选项,缺少标准状况,因此B无法计算,故B错误;
C选项,通入CO2后,根据图中分析A消耗盐酸量的关系,A中是碳酸氢钠和碳酸钠的混合且物质的量之比为2:1,故C错误;
D选项,通入CO2后,C烧杯中75 mL到100mL消耗盐酸25mL,这个阶段发生HCO3-+ H+ = CO2↑+H2O,而CO32-+H+ = HCO3-也要消耗25mL的盐酸,即碳酸钠的物质的量为0.005mol,说明前面用掉50mL盐酸是OH-+H+ = H2O,因此氢氧化钠的物质的量为0.01mol,因此溶质成分的物质的量之比为n(NaOH):n(Na2CO3)=2:1,故D正确;
综上所述,答案为AD。

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目