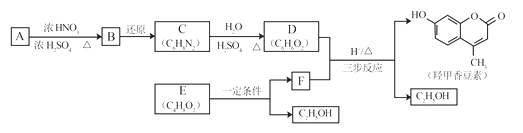
题目内容
【题目】
(1)上图四个装置常用于实验室制取气体,其中制取氯气选用的装置为_______________,反应的离子方程式为______________________。
(2)从下图装置左端分别通入氯气或二氧化硫时,装置B中观察到的现象是否相同________(填“相同”或“不相同”);装置A反应后溶液均褪色,如何利用褪色后的溶液判断是何种气体使其褪色______________(写出简要的实验步骤);

(3)装置F中盛放的溶液为______________(填溶质的化学式);若装置E中试剂为铁丝,则通入氯气与铁丝充分反应的化学方程式为______________;
(4)当通入足量SO2完全反应后,向C中滴加淀粉溶液,无明显现象。该反应的离子方程式为______________。
【答案】甲 4H++2Cl-+MnO2![]() 2H2O + Cl2↑+Mn2+ 不相同 分别取褪色后的A溶液于试管中,加热,若溶液变红色,说明是二氧化硫使其褪色,若不变红,说明是氯气使其褪色 NaOH 2Fe+3Cl2
2H2O + Cl2↑+Mn2+ 不相同 分别取褪色后的A溶液于试管中,加热,若溶液变红色,说明是二氧化硫使其褪色,若不变红,说明是氯气使其褪色 NaOH 2Fe+3Cl2 ![]() 2FeCl3 I2+SO2+2H2O=2I-+4H++SO42-
2FeCl3 I2+SO2+2H2O=2I-+4H++SO42-
【解析】
(1). 实验室通常在甲装置中利用二氧化锰和浓盐酸加热制取氯气,反应的离子方程式为:4H++2Cl-+MnO2![]() 2H2O + Cl2↑+Mn2+,故答案为:甲;4H++2Cl-+MnO2
2H2O + Cl2↑+Mn2+,故答案为:甲;4H++2Cl-+MnO2![]() 2H2O + Cl2↑+Mn2+;
2H2O + Cl2↑+Mn2+;
(2). 氯气与水反应生成HCl和HClO,HCl可以使紫色石蕊试液变红,HClO具有强氧化性,可以漂白石蕊试液使溶液褪色,所以通入氯气后B装置的现象是先变红后褪色,SO2与水反应生成H2SO3,H2SO3具有酸性,可以使紫色石蕊试液变红但不能褪色,所以从装置左端分别通入氯气或二氧化硫时,装置B中观察到的现象不相同,因HClO具有强氧化性,将品红溶液漂白后加热不能恢复为红色,而SO2使品红溶液褪色后加热可以恢复为红色,所以检验的方法是:分别取褪色后的A溶液于试管中,加热,若溶液变红色,说明是二氧化硫使其褪色,若不变红,说明是氯气使其褪色,故答案为:不相同;分别取褪色后的A溶液于试管中,加热,若溶液变红色,说明是二氧化硫使其褪色,若不变红,说明是氯气使其褪色;
(3). 无论是氯气还是二氧化硫都有毒性,可以选用NaOH溶液吸收尾气,防止污染空气,若装置E中试剂为铁丝,则通入氯气与铁丝充分反应生成氯化铁,化学方程式为:2Fe+3Cl2 ![]() 2FeCl3,故答案为:NaOH;2Fe+3Cl2
2FeCl3,故答案为:NaOH;2Fe+3Cl2 ![]() 2FeCl3;
2FeCl3;
(4). 将二氧化硫通入碘水中反应生成硫酸和碘化氢,反应的离子方程式为:I2+SO2+2H2O=2I-+4H++SO42-,所以通入足量SO2完全反应后,向C中滴加淀粉溶液,无明显现象,故答案为:I2+SO2+2H2O=2I-+4H++SO42-。

 阅读快车系列答案
阅读快车系列答案