题目内容
【题目】某温度下,向一定体积0.1mol/L的氨水中逐滴滴加0.1mol/L的盐酸,溶液中pH与pOH[pOH=-lgc(OH-)]的变化关系如右图所示。下列说法正确的是
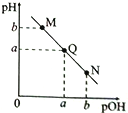
A. M点:(pH+pOH) >2a
B. N点溶液加水稀释, 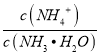 增大
增大
C. M、N两点的溶液中:[cM(NH4+)-cN(C1-)] <[cM(Cl-)-cN(NH4+)]
D. 线段MN上各点所示溶液中水的电离程度最大的不是Q点
【答案】D
【解析】A. 温度不变,水的离子积常数不变,Q点=a时,溶液为中性,Kw= c(H+)c(OH-)=10-2a,因此M点,(pH+pOH) =2a,故A错误;B.N点pH<pOH,c(H+)>c(OH-),溶液中溶质为NH4Cl和HCl,稀释时c(H+)减小,c(OH-)增大,由于Ka=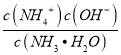 不变,则
不变,则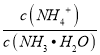 减小,故B错误;C.溶液遵循电荷守恒,不显电性,则M、N两点所示的溶液中均存在c(NH4+)+c(H+)=c(OH-)+c(Cl-),则[cN(NH4+)-cN(C1-)] = cN(OH-)- cN(H+),[cM(Cl-)-cM(NH4+)]= cM(H+)-cM(OH-),由于M、N点的pHM=pOHN,因此cN(OH-)= cM(H+),cN(H+)= cM(OH-),则[cN(NH4+)-cN(C1-)] = [cM(Cl-)-cM(NH4+)],即[cM(NH4+)-cN(C1-)] =[cM(Cl-)-cN(NH4+)],故C错误;D.Q点pH=pOH=a时,溶液为中性,溶质为NH4Cl、一水合氨,在Q点之后存在氯化铵溶液,铵根离子浓度最大,水解程度最大,对水的电离的促进程度最大,因此水的电离程度最大的不是Q点,故D正确;故选D。
减小,故B错误;C.溶液遵循电荷守恒,不显电性,则M、N两点所示的溶液中均存在c(NH4+)+c(H+)=c(OH-)+c(Cl-),则[cN(NH4+)-cN(C1-)] = cN(OH-)- cN(H+),[cM(Cl-)-cM(NH4+)]= cM(H+)-cM(OH-),由于M、N点的pHM=pOHN,因此cN(OH-)= cM(H+),cN(H+)= cM(OH-),则[cN(NH4+)-cN(C1-)] = [cM(Cl-)-cM(NH4+)],即[cM(NH4+)-cN(C1-)] =[cM(Cl-)-cN(NH4+)],故C错误;D.Q点pH=pOH=a时,溶液为中性,溶质为NH4Cl、一水合氨,在Q点之后存在氯化铵溶液,铵根离子浓度最大,水解程度最大,对水的电离的促进程度最大,因此水的电离程度最大的不是Q点,故D正确;故选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目


