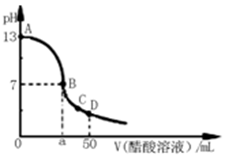
题目内容
常温下,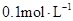 某一元酸
某一元酸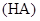 溶液中
溶液中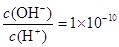 ,下列说法正确的是( )
,下列说法正确的是( )
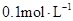 某一元酸
某一元酸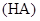 溶液中
溶液中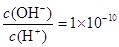 ,下列说法正确的是( )
,下列说法正确的是( )A.溶液中由水电离出的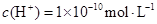 |
B.溶液中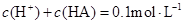 |
C.与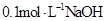 溶液等体积混合后所得溶液中 溶液等体积混合后所得溶液中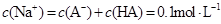 |
D.原溶液中加入一定量NaA晶体或加水稀释,溶液中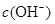 均增大 均增大 |
D
结合常温下水的离子积可计算出溶液中c(H+)=1×10—2mol/L,c(OH—)=1×10—12mol/L,可见酸HA为部分电离,属于弱酸
A:酸溶液中OH—全部由水电离产生,故水电离出c(H+)=1×10—12mol/L
B:由物料守恒可知c(HA)+c(A—)=0.1mol/L
C:两溶液混合后,体积增大一倍,故c(Na+)=c(HA)+c(A—)=0.05mol/L
D:电离平衡HA H++A—可知,加入NaA晶体时,A—浓度增大,平衡左移,c(H+)减小,c(OH—)增大;加水稀释,溶液酸性减弱,c(H+)减小,c(OH—)增大,故正确
H++A—可知,加入NaA晶体时,A—浓度增大,平衡左移,c(H+)减小,c(OH—)增大;加水稀释,溶液酸性减弱,c(H+)减小,c(OH—)增大,故正确
答案为D
A:酸溶液中OH—全部由水电离产生,故水电离出c(H+)=1×10—12mol/L
B:由物料守恒可知c(HA)+c(A—)=0.1mol/L
C:两溶液混合后,体积增大一倍,故c(Na+)=c(HA)+c(A—)=0.05mol/L
D:电离平衡HA
 H++A—可知,加入NaA晶体时,A—浓度增大,平衡左移,c(H+)减小,c(OH—)增大;加水稀释,溶液酸性减弱,c(H+)减小,c(OH—)增大,故正确
H++A—可知,加入NaA晶体时,A—浓度增大,平衡左移,c(H+)减小,c(OH—)增大;加水稀释,溶液酸性减弱,c(H+)减小,c(OH—)增大,故正确答案为D

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目