题目内容
下列说法正确的是
| A.物质的量浓度和体积相同的K2CO3、K2SO4、HCl溶液混合后,溶液的pH<7 |
| B.将0.1mol/L CH3COOH溶液加水稀释,溶液中的c( H + )/ c (CH3COOH)减小 |
| C.t℃时,某稀Ba(OH)2溶液中c(H+)·c(OH-)=1.0×10-12。向pH = 8的该溶液中加入等体积pH = 4的盐酸,则混合后溶液的pH =" 6" |
| D.10mL pH = 12的氢氧化钠溶液中加入pH = 2的HA至pH刚好等于7,所得溶液体积V总≥20mL |
C
A.物质的量浓度和体积相同的K2CO3、K2SO4、HCl溶液混合,反应生成KHCO3,显碱性,故溶液的pH>7,A错误。
B.将0.1mol/L CH3COOH溶液加水稀释,CH3COO-浓度减小,但电力平衡常数不变,故c( H + )/ c (CH3COOH)增大,B错误。
C.t℃时,水的离子积常数为1.0×10-12。则pH = 8的Ba(OH)2溶液中氢氧根离子浓度与pH = 4的盐酸中氢离子浓度相等,等体积混合后,酸碱恰好反应完毕,生成强酸强碱盐,显中性,pH = 6,C正确。
D.若HA为强酸,则V=10mL;若HA为弱酸,则V>10mL。故V总≥10mL,D错误。
故选C
B.将0.1mol/L CH3COOH溶液加水稀释,CH3COO-浓度减小,但电力平衡常数不变,故c( H + )/ c (CH3COOH)增大,B错误。
C.t℃时,水的离子积常数为1.0×10-12。则pH = 8的Ba(OH)2溶液中氢氧根离子浓度与pH = 4的盐酸中氢离子浓度相等,等体积混合后,酸碱恰好反应完毕,生成强酸强碱盐,显中性,pH = 6,C正确。
D.若HA为强酸,则V=10mL;若HA为弱酸,则V>10mL。故V总≥10mL,D错误。
故选C

练习册系列答案
相关题目
 某一元酸
某一元酸 溶液中
溶液中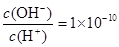 ,下列说法正确的是( )
,下列说法正确的是( )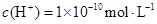
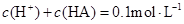
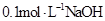 溶液等体积混合后所得溶液中
溶液等体积混合后所得溶液中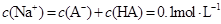
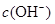 均增大
均增大 )由大到小的顺序是:②>①>④>③
)由大到小的顺序是:②>①>④>③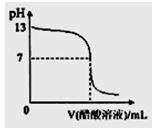
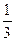 y,则x值为
y,则x值为