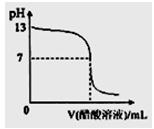
题目内容
25℃时,浓度均为0.1 moI.L-l的HA溶液和BOH溶液,pH分别是l和11。下列说法正确的是( )
| A.BOH溶于水,其电离方程式是BOH=B++ OH |
| B.若一定量的上述两溶液混合后pH=7,则c(A—)=c(B+) |
| C.在0.1 mol·L-lBA溶液中,c(B+)>c(A一)> c(OH-)>c(H+) |
| D.若将0.1mol·L-lBOH溶液稀释至0.001mol·L-1,则溶液的pH=9 |
B
A 错误 题设知:HA为强酸,因pH为1 知其全部电离。BOH为弱碱,因pH11,反之pH应为13,故电离方程式中符号应改为可逆号
B 正确 由pH=7知溶液呈中性 依电荷守恒:B+与H+之和等于A一与OH-之和 而溶液中氢离子与氢氧根离子浓度相等 故知c(A—)=c(B+)
C 错误 BA为强酸弱碱盐 阳离子引起水解 其浓度变小 即c(B+)<c(A一)
D 错误BOH为弱碱, 稀释后pH>9
B 正确 由pH=7知溶液呈中性 依电荷守恒:B+与H+之和等于A一与OH-之和 而溶液中氢离子与氢氧根离子浓度相等 故知c(A—)=c(B+)
C 错误 BA为强酸弱碱盐 阳离子引起水解 其浓度变小 即c(B+)<c(A一)
D 错误BOH为弱碱, 稀释后pH>9

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
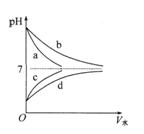
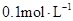 某一元酸
某一元酸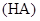 溶液中
溶液中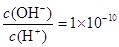 ,下列说法正确的是( )
,下列说法正确的是( )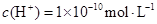
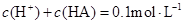
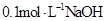 溶液等体积混合后所得溶液中
溶液等体积混合后所得溶液中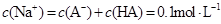
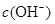 均增大
均增大