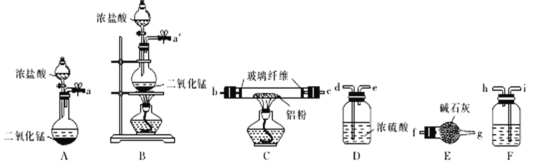
ћвƒњƒЏ»Ё
°Њћвƒњ°њCuClЇЌCuCl2ґЉ «÷Ў“™µƒїѓє§‘≠Ѕѕ£ђ≥£”√„чіяїѓЉЅ°Ґ—’Ѕѕ°ҐЈјЄѓЉЅЇЌѕыґЊЉЅµ»°£
“—÷™£ЇҐўCuClњ…“‘”…CuCl2”√ µ±µƒїє‘≠ЉЅ»зSO2£ђSnCl2µ»їє‘≠÷∆µ√£Ї
2Cu2£Ђ£Ђ2Cl£≠£ЂSO2£Ђ2H2O![]() 2CuCl°э£Ђ4H£Ђ£ЂSO42-
2CuCl°э£Ђ4H£Ђ£ЂSO42-
2CuCl2£ЂSnCl2=2CuCl°э£ЂSnCl4
ҐЏCuCl2»№“Ї”л““ґю∞Ј(H2N°™CH2°™CH2°™NH2)њ…–ќ≥…≈дјл„”£Ї
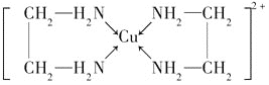
«лїЎірѕ¬Ѕ–ќ ћв£Ї
(1)їщћђCu‘≠„”µƒЇЋЌвµз„”≈≈≤Љ љќ™_________£їH°ҐN°ҐO»э÷÷‘™ЋЎµƒµзЄЇ–‘”…іуµљ–°µƒЋ≥–т «_____________
(2)SO2Ј÷„”µƒњ’Љдєє–Ќќ™_____________
(3)““ґю∞ЈЈ÷„”÷–µ™‘≠„”ємµјµƒ‘”їѓја–Ќќ™_________““ґю∞ЈЇЌ»эЉ„∞Ј[N(CH3)3]Њщ ф”Џ∞Ј£ђµЂ““ґю∞Ј±»»эЉ„∞ЈµƒЈ–µгЄяµ√ґа£ђ‘≠“т «_____________
(4)ҐЏ÷–Ћщ–ќ≥…µƒ≈дјл„”÷–Їђ”–µƒїѓ—ІЉьја–Ќ”–______(ћо„÷ƒЄ)°£
A.≈дќїЉь B.ЉЂ–‘Љь C.јл„”Љь D.Ј«ЉЂ–‘Љь
°Њір∞Є°њ1s22s22p63s23p63d104s1їт[Ar]3d104s1 O£ЊN£ЊH V–ќ sp3‘”їѓ ““ґю∞ЈЈ÷„”Љдƒ№–ќ≥…«вЉьґш»эЉ„∞ЈЈ÷„”÷ЃЉд≤їƒ№–ќ≥…«вЉь ABD
°Њљвќц°њ
(1)ЄщЊЁЌ≠µƒ‘≠„”–т эќ™29£ђљбЇѕƒ№Ѕњ„оµЌ‘≠јн й–іїщћђ‘≠„”µƒµз„”≈≈≤Љ љ£ђЄщЊЁµзЄЇ–‘µƒ±дїѓєж¬…±»љѕµзЄЇ–‘іу–°£ї
(2)ЄщЊЁ≈–ґѕSO2Ј÷„”Їђ”–µƒ¶“Љь“‘Љ∞є¬µз„”ґ‘ э≈–ґѕњ’Љдєє–Ќ£ї
(3)ЄщЊЁЉџ≤гµз„”ґ‘ э≈–ґѕ““ґю∞ЈЈ÷„”÷–µ™‘≠„”µƒ‘”їѓја–Ќ£ђЄщЊЁ «ЈсЇђ”–«вЉьЈ÷ќцґю’я»џЈ–µгЄяµЌ≤їЌђµƒ‘≠“т£ї
(4)ЄщЊЁ≥…Љь‘≠„”µƒћЎµг≈–ґѕїѓ—ІЉьја–Ќ°£
(1)Ќ≠µƒ‘≠„”–т эќ™29£ђЄщЊЁƒ№Ѕњ„оµЌ‘≠јн∆дћђ‘≠„”µƒµз„”≈≈≤Љ љќ™1s22s22p63s23p63d104s1їт[Ar]3d104s1£ђ‘Џ‘™ЋЎ÷№∆Џ±н÷–Ќђ“ї÷№∆Џі”„уµљ”“‘™ЋЎµƒµзЄЇ–‘÷рљ•‘ц«њ£ђЌђ“ї÷ч„еі”…ѕµљѕ¬‘™ЋЎµƒµзЄЇ–‘÷рљ•Љх»х£ђњ…÷™µзЄЇ–‘«њ»хЋ≥–тќ™O£ЊN£ЊH£ї
(2)SO2Ј÷„”÷–Їђ”–2Єц¶“Љь£ђє¬µз„”ґ‘ э=![]() =1£ђЋщ“‘Ј÷„”ќ™V–ќ£ї
=1£ђЋщ“‘Ј÷„”ќ™V–ќ£ї
(3)““ґю∞ЈЈ÷„”÷–µ™‘≠„”–ќ≥…4Єц¶“Љь£ђЉџ≤гµз„”ґ‘ эќ™4£ђµ™‘≠„”ќ™sp3‘”їѓ£ђ““ґю∞ЈЈ÷„”Љдњ…“‘–ќ≥…«вЉь£ђќп÷ µƒ»џЈ–µгљѕЄя£ђґш»эЉ„∞ЈЈ÷„”Љд≤їƒ№–ќ≥…«вЉь£ђ»џЈ–µгљѕµЌ£ї
(4)ҐЏ÷–Ћщ–ќ≥…µƒ≈дјл„”÷–Їђ”–µƒїѓ—ІЉь÷–N”лCu÷ЃЉдќ™≈дќїЉь£ђC-CЉьќ™Ј«ЉЂ–‘Љь£ђC-N°ҐN-H°ҐC-HЉьќ™ЉЂ–‘Љь£ђ≤їЇђјл„”Љь£ђє ір∞Єќ™£ЇABD£ї