题目内容
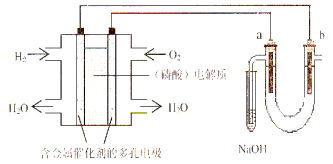
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究。
回答下列问题:
(1)图中D装置名称是 。
(2)从以下所给物质中选出甲同学设计的实验所用到物质:
①稀HNO3溶液②稀盐酸③碳酸钙④Na2SiO3溶液⑤SiO2
试剂A为_________;试剂C为_________(填序号)。
(3)乙同学设计的实验所用到试剂A为________;试剂C为________。
【答案】(1)长颈漏斗(2)①;④(3)双氧水;氢硫酸或硫化钠溶液。
【解析】试题分析:(1)由装置图可知,装置图中D的名称长颈漏斗,故答案为:长颈漏斗;
(2)通过比较酸性强弱来判断非金属性强弱,装置中为强酸制备弱酸,所以A中试剂为稀硝酸,B中为碳酸钙,C中为Na2SiO3溶液,试管C中为二氧化碳与硅酸钠溶液的反应,其离子方程式为:SiO32-+CO2+H2O═H2SiO3↓+CO32-;故答案为:①;④;
(3)完成了O元素的非金属性比S强的实验研究,通过比较单质的氧化性来判断非金属性,所以用二氧化锰作催化剂使双氧水分解生成氧气,氧气通过氢硫酸或硫化钠溶液会生成硫单质,其反应的方程式为:2H2S+O2=2S↓+2H2O;故答案为:双氧水;氢硫酸。

【题目】下表中物质的分类组合完全正确的是
编 号 | A | B | C | D |
强电解质 | KNO3 | H2SO4 | Ba(OH)2 | BaSO4 |
弱电解质 | CH3COOH | CaCO3 | H2S | NH3·H2O |
非电解质 | SO2 | CO2 | Cl2 | C2H5OH溶液 |
A. A B. B C. C D. D
【题目】下表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空。
族 周期 | ⅠA | 0 | ||||||||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||||||||
2 | X | Y | G | |||||||||||
3 | Z | …… | H | W | E | Q | ||||||||
(1)上述元素的原子中,得电子能力最强的是______________(填元素名称)。
2)化学性质最不活泼的是___________(填元素符号)。
(3)G对应离子的半径______________Z对应离子的半径(填“<”或“>”)。
(4)写出H与Z的最高价氧化物的水化物溶液反应的离子方程式:________________。
(5)元素X的最高价氧化物的电子式________________,元素W的最高价氧化物为
_______________(填晶体类型)。
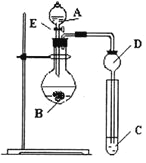
(6)为比较元素X和W的非金属性强弱,用下图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B的作用是________________,能说明X和W非金属性强弱的化学方程式是_________________________________。