题目内容
3.有甲、乙两位同学根据所学化学知识,设计了由铜和硫酸为原料制取硫酸铜的两种方案:①铜与浓硫酸加热直接反应,即Cu→CuS04②将铜加到热的稀硫酸中并通入空气来制备硫酸铜,即由Cu→CuO→CuSO4,
试回答:
(1)、写出方案①的化学反应方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
这两种方案,你认为哪一种方案比较合理?②.(答编号),理由是无污染物产生,节约原料
(2)、实验室采用方案①取6.4g铜片和10mL 18mol•L-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀.甲、乙两位同学为了验证其中灰白色沉淀的主要成分,设计下列实验:
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌
实验现象:沉淀中白色物质溶解,溶液为蓝色
实验结论:所得灰白色固体的化学式为_CuSO4
直到最后反应完毕,发现试管中还有铜片剩余.可两位同学仍然认为试管中还有硫酸剩余,他们这样认为的理由是随着反应的进行,浓硫酸的浓度逐渐变小,由浓变稀,稀硫酸不能与铜发生反应.
分析 (1)①铜与浓硫酸加热直接反应,生成二氧化硫,会污染环境,②由Cu→CuO→CuSO4,不生成有害气体,且消耗酸少,以此来解答;
(2)硫酸铜粉末为白色,而硫酸铜溶液为蓝色,浓硫酸随反应进行浓度变稀,稀硫酸不与铜反应,以此来分析.
解答 解:(1)方案①的化学反应方程式为,根据方程式Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O 可知①生成有害气体二氧化硫,②中不生成有害气体二氧化硫,且消耗酸少,所以方案②比较合理,
故答案为:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;②;无污染物产生,节约原料;
(2)灰白色的固体中加入适量蒸馏水,观察到沉淀中白色物质溶解,溶液为蓝色,所得白色固体为CuSO4,随着反应的进行,浓硫酸的浓度逐渐变小,由浓变稀,稀硫酸不能与铜发生反应,
故答案为:沉淀中白色物质溶解,溶液为蓝色;CuSO4;随着反应的进行,浓硫酸的浓度逐渐变小,由浓变稀,稀硫酸不能与铜发生反应.
点评 本题考查浓硫酸的性质,明确浓硫酸具有强氧化性及发生的化学反应是解答本题的关键,掌握基础是关键,难度不大.

练习册系列答案
相关题目
17.利用如图装置,可以模拟铁的电化学防护.下列关于该装置的叙述中正确的是( )
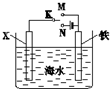

| A. | 若X为Zn时,则开关K置于M或N时均可减缓铁的腐蚀 | |
| B. | 若X为Cu时,为减缓铁的腐蚀,开关K应置于M处 | |
| C. | 若X为石墨、开关K置于M时,X电极上的反应为2H++2e-=H2↑ | |
| D. | 若X为石墨、开关K置于N时,铁电极上的反应为Fe-2e-=Fe2+ |
18.下列说法正确的是( )
| A. | 22.4LCO中一定含有6.02×1023个分子 | |
| B. | 44gCO2在标准状况下的体积约为22.4L | |
| C. | 将40gNaOH溶于1L水中.所得溶液中NaOH的物质的量浓度为1mol/L | |
| D. | 在标准状况下,20mL NH3与60mLO2所含的分子数之比为1:3 |
15.柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4•7H2O)通过下列反应制备:FeSO4+Na2CO3═FeCO3↓+Na2SO4;FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O.
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
(1)制备FeCO3时,选用的加料方式是c(填字母),原因是避免生成Fe(OH)2沉淀.
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是取最后一次的洗涤滤液1~2mL于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净.
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应.
①铁粉的作用是防止+2价的铁元素被氧化.
②反应结束后,无需过滤,除去过量铁粉的方法是加入适量柠檬酸让铁粉反应完全.
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出.
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是取最后一次的洗涤滤液1~2mL于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净.
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应.
①铁粉的作用是防止+2价的铁元素被氧化.
②反应结束后,无需过滤,除去过量铁粉的方法是加入适量柠檬酸让铁粉反应完全.
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出.
12.实验室里用如图所示仪器和药品来制取纯净的无水氯化铜.图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长等部分未画出.根据要求填写下列各小题空白.
(1)如果所制气体从左向右流动时,上述各仪器装置的正确连接顺序是(填各装置的序号)3接5接4接2接1接6.
(2)装置②的作用是干燥氯气;
(3)装置④的作用是除去氯气中的氯化氢;
(4)装置⑥中发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(5)实验开始时,应首先检验装置的检验装置气密性,实验结束时,应先熄灭①处的酒精灯.
(6)在装置⑤的烧瓶中,发生反应的化学方程式为MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪 器 及 装 置 图 |  |  |  |  |  |  |
(2)装置②的作用是干燥氯气;
(3)装置④的作用是除去氯气中的氯化氢;
(4)装置⑥中发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(5)实验开始时,应首先检验装置的检验装置气密性,实验结束时,应先熄灭①处的酒精灯.
(6)在装置⑤的烧瓶中,发生反应的化学方程式为MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.

 50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: