题目内容
2.实验室可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O(1)请用“双线桥”标出电子转移的方向和数目:
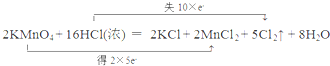
(2)在该反应中,氧化剂是KMnO4;
(3)当有0.2mol电子发生转移时,生成氯气的体积为2.24L(标准状况),发生反应的KMnO4的质量为6.32g.
分析 (1)反应中KMnO4为氧化剂,Mn元素的化合价由+7价降低到+2价,得到5个电子,Cl元素化合价升高,被氧化;
(2)含元素化合价降低的物质为氧化剂;
(3)由反应可知,0.2mol电子发生转移时,生成0.1molCl2,消耗KMnO4为0.1mol×$\frac{2}{5}$.
解答 解:(1)反应中KMnO4为氧化剂,Mn元素的化合价由+7价降低到+2价,得到5个电子,Cl元素化合价升高,被氧化,当有2molKMnO4参加反应,转移电子10mol,则电子转移的方向和数目可表示为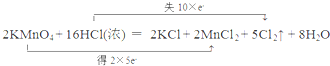 ,
,
故答案为: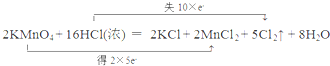 ;
;
(2)Mn元素的化合价降低,则KMnO4为氧化剂,故答案为:KMnO4;
(3)由反应可知,0.2mol电子发生转移时,生成0.1molCl2,其标况下体积为0.1mol×22.4L/mol=2.24L;消耗KMnO4为0.1mol×$\frac{2}{5}$=0.04mol,其质量为0.04mol×158g/mol=6.32g,故答案为:2.24L;6.32g.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价及反应中物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.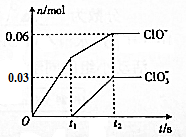 将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )
将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )
 将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )
将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )| A. | 3:7 | B. | 7:3 | C. | 3:2 | D. | 2:3 |
10. 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:
CH3CH2CH2CH2OH $→_{H_{2}SO_{4}加热}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,浓硫酸溶于水放出大量热,容易发生迸溅伤人.
(2)加入沸石的作用是防止暴沸
(3)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(4)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”)
(6)反应温度应保持在90-95℃,其原因是:保证正丁醛及时蒸出,促使反应正向进行,又可尽量避免其被进一步氧化
(7)本实验中,正丁醛的产率为51%
(8)已知正丁醛在碱性条件下可以被新制氢氧化铜氧化,写出该反应的化学方程式:CH3CH2CH2CHO+NaOH+2Cu(OH)2$\stackrel{△}{→}$CH3CH2CH2COONa+Cu2O↓+3H2O.
 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH $→_{H_{2}SO_{4}加热}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/0C | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,浓硫酸溶于水放出大量热,容易发生迸溅伤人.
(2)加入沸石的作用是防止暴沸
(3)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(4)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”)
(6)反应温度应保持在90-95℃,其原因是:保证正丁醛及时蒸出,促使反应正向进行,又可尽量避免其被进一步氧化
(7)本实验中,正丁醛的产率为51%
(8)已知正丁醛在碱性条件下可以被新制氢氧化铜氧化,写出该反应的化学方程式:CH3CH2CH2CHO+NaOH+2Cu(OH)2$\stackrel{△}{→}$CH3CH2CH2COONa+Cu2O↓+3H2O.
8.苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用下列装置(图A中的加热装置没有绘出)制取高纯度的苯甲酸甲酯,实验前他们从有关化学手册中查得有关物质的物理性质如表所示
实验一:制取苯甲酸甲酯
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,试管中盛放的液体可能是Na2CO3溶液,烧瓶中反应的方程式 ,要想提高苯甲酸的转化率,可以采取的措施是加入过量的甲醇、移去苯甲酸甲酯
,要想提高苯甲酸的转化率,可以采取的措施是加入过量的甲醇、移去苯甲酸甲酯
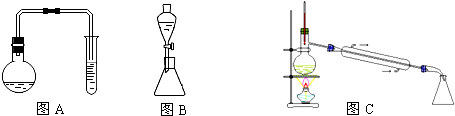
实验二:提纯苯甲酸甲酯
(2)停止加热,待烧瓶内的混合物冷却后,将试管及烧瓶中的液体转移到分液漏斗中,然后塞上分液漏斗的塞子再振荡后静置后,取下塞子、打开活塞,使(填主要成分的名称)苯甲酸甲酯进入锥形瓶,此时目标产物中所含杂质最多的物质是甲醇.
(3)用图C装置进行蒸馏提纯时,当温度计显示199.6 0C 时,可用锥形瓶收集苯甲酸甲酯.
实验三:探究浓硫酸在合成苯甲酸甲酯中的作用
(4)为确定浓硫酸对此反应存在催化作用,可另取等量反应物在不加浓硫酸情况下进行相同程度的加热,然后测量两个实验中的某种数据,该数据是相同时间内两个试管里生成有机层的厚度或两个试管中生成相同厚度的有机层所需的时间.
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,试管中盛放的液体可能是Na2CO3溶液,烧瓶中反应的方程式
 ,要想提高苯甲酸的转化率,可以采取的措施是加入过量的甲醇、移去苯甲酸甲酯
,要想提高苯甲酸的转化率,可以采取的措施是加入过量的甲醇、移去苯甲酸甲酯
实验二:提纯苯甲酸甲酯
(2)停止加热,待烧瓶内的混合物冷却后,将试管及烧瓶中的液体转移到分液漏斗中,然后塞上分液漏斗的塞子再振荡后静置后,取下塞子、打开活塞,使(填主要成分的名称)苯甲酸甲酯进入锥形瓶,此时目标产物中所含杂质最多的物质是甲醇.
(3)用图C装置进行蒸馏提纯时,当温度计显示199.6 0C 时,可用锥形瓶收集苯甲酸甲酯.
实验三:探究浓硫酸在合成苯甲酸甲酯中的作用
(4)为确定浓硫酸对此反应存在催化作用,可另取等量反应物在不加浓硫酸情况下进行相同程度的加热,然后测量两个实验中的某种数据,该数据是相同时间内两个试管里生成有机层的厚度或两个试管中生成相同厚度的有机层所需的时间.