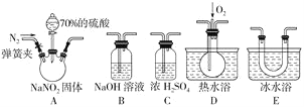
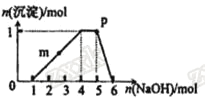
题目内容
【题目】关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节诱发关节疼痛,其化学历程为:
①HUr(尿酸)+H2O![]() Ur-(尿酸根离子)+H3O+;
Ur-(尿酸根离子)+H3O+;
②Ur-(aq)+Na+(aq)![]() NaUr(s)37℃时Ksp(NaUr)=6.4×10-6
NaUr(s)37℃时Ksp(NaUr)=6.4×10-6
下列叙述中错误的是
A.反应的ΔH<0B.减少食盐的摄入,缓解疼痛症状
C.Ksp(NaUr)随着温度的降低而降低D.升高温度,平衡向正反应方向移动
【答案】D
【解析】
A.由题目信息可知,关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节能诱发关节疼痛,说明温度越低,越有利于尿酸钠的形成,降低温度平衡向放热方向移动,因此反应的ΔH<0,故A不符合题意;
B.食盐中含有Na+,减小食盐的摄入,能够降低该反应的反应物浓度,能够减少尿酸钠的形成,从而缓解疼痛症状,故B不符合题意;
C.![]() ,反应②属于放热反应,温度降低,平衡正向移动,
,反应②属于放热反应,温度降低,平衡正向移动,![]() 、
、![]() 均会减小,因此Ksp会降低,故C不符合题意;
均会减小,因此Ksp会降低,故C不符合题意;
D.该反应为放热反应,升高温度,平衡将向逆反应方向移动,故D符合题意;
故答案为:D。

【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
已知化学键键能数据如表:
化学健 | C﹣H | C=O | H﹣H | C≡O(CO) | ||
键能(kJ/mol) | 413 | 745 | 436 | 1075 |
(1)①CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。则该反应的△H=_____________。
2CO(g)+2H2(g)。则该反应的△H=_____________。
②在恒容绝热条件下,一定能说明该反应已达平衡状态的是_____________。(填字母)
A.混合气体的密度不再变化B.混合气体的平均相对分子质量不再变化
C.容器内的温度不再变化D.v正(CH4)=2v逆(H2)
(2)利用CO2可制取甲醇,其反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);△H=-49.0KJ/mol;为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在恒温恒容密闭容器中,充入2molCO2和6molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图1所示。从反应开始到平衡,v(H2)=_____________;该温度下的平衡常数数值=_____________(保留三位有效数字)。
CH3OH(g)+H2O(g);△H=-49.0KJ/mol;为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在恒温恒容密闭容器中,充入2molCO2和6molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图1所示。从反应开始到平衡,v(H2)=_____________;该温度下的平衡常数数值=_____________(保留三位有效数字)。
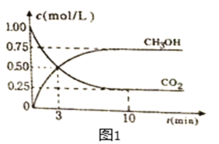
(3)下列措施能使![]() 增大的是________。
增大的是________。
A.降低温度
B.恒温恒容下,再充入2molCO2、6molH2
C.使用高效催化剂
D.恒温恒容充入He(g)使体系压强增大
(4)一种熔融碳酸盐燃料电池原理示意如图2。
①该电池的负极反应式为_____________
②电池工作时,CO32﹣向电极_____________移动(填A或者B)。