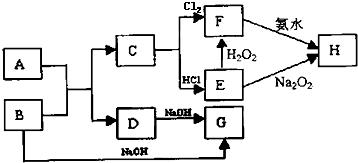
题目内容
11.现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出).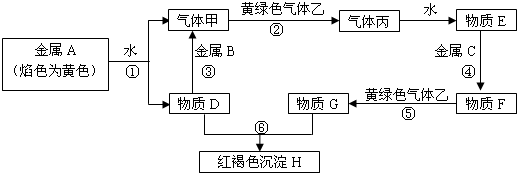
请根据图中信息回答下列问题:
(1)写出下列物质的化学式:BAl、CFe、HFe(OH)3、丙HCl
(2)写出下列反应离子方程式:
反应①2Na+2H2O=2Na++2OH-+H2↑ 反应③2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)反应⑤属于下列反应类型中AC(填写序号).
A.氧化还原反应 B.分解反应 C.化合反应 D.复分解反应.
分析 金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,H为红褐色沉淀,为Fe(OH)3;由反应①Na→气体甲+D,故甲为H2,D为NaOH,由NaOH+金属B→H2,可知B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)$\stackrel{C}{→}$F$\stackrel{Cl_{2}}{→}$G,可知C为Fe,F为FeCl2,G为FeCl3,据此解答.
解答 解:金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,H为红褐色沉淀,为Fe(OH)3;由反应①Na→气体甲+D,故甲为H2,D为NaOH,由NaOH+金属B→H2,可知B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)$\stackrel{C}{→}$F$\stackrel{Cl_{2}}{→}$G,可知C为Fe,F为FeCl2,G为FeCl3.
(1)由上述分析可知,B为Al,C为Fe,H为Fe(OH)3,丙为HCl,
故答案为:Al;Fe;Fe(OH)3;HCl;
(2)反应①的离子方程式:2Na+2H2O=2Na++2OH-+H2↑,反应③的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)反应⑤是:2FeCl2+Cl2═2FeCl3,属于化合反应、氧化还原反应,
故答案为:AC.
点评 本题考查无机物推断,涉及Na、Al、Fe、Cl等元素单质及其化合物之间的相互转化关系,颜色及特殊反应为推断突破口,难度中等,注意基础知识的掌握.


| A. | X和R在同一周期 | |
| B. | 原子半径:W>R>X | |
| C. | 气态氢化物的稳定性:Y>X | |
| D. | X、Z可形成化学式为Z2X和Z2X2的化合物 |
| A. | 28 g乙烯和28g丙烯中均含有6NA对共用电子对 | |
| B. | 标准状况下,2.24L氯仿中含有C-Cl数目为0.3NA | |
| C. | 标准状况下,560 mL甲烷和甲醛的混合气体中,含有的共用电子对数为0.2NA | |
| D. | 11.2L乙烯、乙炔的混合物中C原子数为NA |
| A. | 许多金属和合金具有低温下失去电阻的特性,即具有超导性 | |
| B. | 两个较轻的原子核聚合为一个较重的原子核时要释放出大量的能量,所释放的能量可用于发电 | |
| C. | 天然的、人为的各种电磁波干扰和有害的电磁辐射会造成电磁污染 | |
| D. | 美国科学家利用分子组装技术研制出世界上最小的“纳米算盘”,该算盘的算珠由球形C60分子构成 |
| A. | 正常雨水的pH为7.0,酸雨的pH小于7.0 | |
| B. | 严格执行机动车尾气排放标准有利于防止大气污染 | |
| C. | 使用二氧化硫和某些含硫化合物漂白食品会对人体健康产生危害 | |
| D. | 使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害 |
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示: