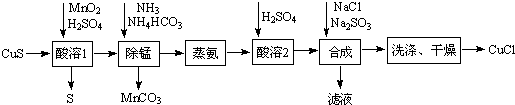
题目内容
2. 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:(1)从反应开始到10s,用Z表示的反应速率为0.079 mol/(L•s).X的物质的量浓度减少了0.395 mol•L-1 ,Y的转化率为79.0%.
(2)该反应的化学方程式为:X(g)+Y(g)?2Z(g)
(3)若为恒温、恒容,通入氦气后速率不变(填“减小”、“不变”或“增大”),若为恒温、恒压,通入氩气后速率减小 (填“减小”、“不变”或“增大”).
分析 图象分析可知起始量为:X=1.2mol,Y=1.00mol,Z=1.58mol,10s达到平衡状态xyz的物质的量为:0.41mol,0.21mol,1.58mol
(1)反应速率v=$\frac{△c}{△t}$,浓度c=$\frac{n}{V}$,转化率=$\frac{消耗量}{起始量}$×100%;
(2)反应的化学方程式计量数之比等于物质参加反应的物质的量之比,据此写出化学方程式;
(3)影响化学反应速率的因素:浓度,增大浓度,速率加快,减小浓度,速率减慢.
解答 解:图象分析可知起始量为:X=1.2mol,Y=1.00mol,Z=1.58mol,10s达到平衡状态xyz的物质的量为:0.41mol,0.21mol,1.58mol,△X=1.2mol-0.41mol=0.79mol,△Y=1.00mol-0.21mol=0.79mol,△Z=1.58mol
(1)反应速率v(Z)=$\frac{△c}{△t}$=$\frac{\frac{1.58mol}{2L}}{10s}$=0.079mol/(L•s),
X的浓度减小c=$\frac{n}{V}$=$\frac{0.79mol}{2L}$=0.395mol/L,
Y转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.79mol}{1.00mol}$×100%=79%;
故答案为:0.079mol/(L•s);0.395mol/L;79%;
(2)n(X):n(Y):n(Z)=0.79:0.79:1.58=1:1:2,反应的化学方程式计量数之比等于物质参加反应的物质的量之比,可知化学方程式为:X+Y?2Z,
故答案为:X+Y?2Z;
(3)若为恒温、恒容,通入氦气后,各组分的浓度不变,所以速率不变,若为恒温、恒压,通入氩气后,体系的体积变大,所以各组分的浓度减小,反应速率减慢,
故答案为:不变;减小.
点评 本题考查学生化学反应速率的计算以及影响化学反应速率的因素等知识,属于综合知识的考查,难度中等.

①O-H…O ②N-H…N ③F-H…F ④O-H…N.
| A. | ③>①>④>② | B. | ①>②>③>④ | C. | ③>②>①>④ | D. | ①>④>③>② |
| A. | 铊是易导电的银白色金属 | B. | 能生成+3价离子 | ||
| C. | 氢氧化铊是两性氢氧化物 | D. | Tl3+的氧化能力比Al3+弱 |
| A. | 1 mol CO2中含有原子数NA | |
| B. | 1mol/L的硫酸钠溶液中,所含Na+数为2NA | |
| C. | 标准状况下,11.2 L水所含分子数为0.5 NA | |
| D. | 1 mol Fe和足量盐酸完全反应失去的电子数为2NA |
| A. | 20 mol | B. | 10 mol | C. | 5 mol | D. | 30 mol |