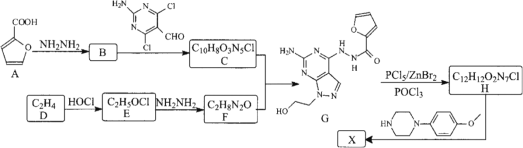
题目内容
【题目】海水资源的利用具有广阔的前景。从海水中提取 Br2与 MgCl2 6 H2O 的流程如下:
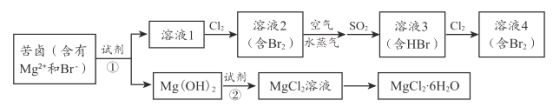
(1)为节约成本 ,试剂①最好选用____________。[填“NaOH”或“Ca( OH )2”]
(2)提取溴过程中,从溶液 l 到溶液 4 , 两次进行 Br -→Br2的转化,目的是____。
(3)提取溴过程中,形成溶液 3 的化学方程式是___________________ 。
(4)用原子结构原理解释Cl2的氧化性强于 Br2的原因 ___________________。
(5)提镁过程中,加入试剂②发生反应的离子方程式是 _________________。
(6)从 MgCl2溶液获得MgCl26 H2O晶体的主要操作为_______________。
【答案】Ca(OH)2 富集溴 Br2+SO2+2H2O=2HBr+H2SO4 氯原子半径较小,得电子的能力更强 Mg(OH)2+2H+=Mg2++2H2O 蒸发浓缩、冷却结晶、过滤
【解析】
苦卤(含有Mg2+和Brˉ),加入试剂①得到Mg(OH)2沉淀和溶液1,则试剂①应为碱性物质,为降低成本最好选用Ca(OH)2;溶液1中含有溴离子,通入氯气将溴离子氧化成溴单质,利用空气和水蒸气将溴吹出,利用SO2将溴单质还原成HBr,得到溶液3,再利用氯气将溶液3中的溴离子氧化成溴单质,得到溶液4;Mg(OH)2与盐酸反应得到MgCl2溶液,蒸发浓缩、冷却结晶,过滤得到MgCl26H2O晶体。
(1)煅烧贝壳、石灰石等物质可以得到CaO,CaO与水反应可以得到Ca(OH)2,所以为节约成本,试剂①最好选用Ca(OH)2;
(2)海水中溴的含量较低,得到的溶液1中溴离子浓度较大,经过系列工序得到含溴离子浓度较大的溶液4,实现溴的富集;
(3)溴单质具有氧化性,可以将SO2氧化成SO![]() ,根据电子守恒和元素守恒可得化学方程式为:Br2+SO2+2H2O=2HBr+H2SO4;
,根据电子守恒和元素守恒可得化学方程式为:Br2+SO2+2H2O=2HBr+H2SO4;
(4)氯原子核外有3层电子,溴原子核外有4层电子,氯原子半径较小,得电子的能力更强,氧化性更强;
(5)提镁过程中,向氢氧化镁沉淀中加入盐酸可得氯化镁溶液,离子方程式为:Mg(OH)2+2H+=Mg2++2H2O;
(6)从MgCl2溶液获得MgCl26 H2O晶体的主要操作为:蒸发浓缩、冷却结晶、过滤。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案【题目】CoCO3可用作选矿剂、催化剂及家装涂料的颜料。以含钴废渣(主要成份CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
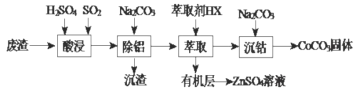
下列说法不正确的是( )
A.“酸溶”时发生氧化还原反应的离子方程式Co2O3+SO2+2H+=2Co2++H2O+SO42-
B.“除铝”过程中需要调节溶液 pH 的范围为5.0~5.4
C.在实验室里,“萃取”过程用到的玻璃仪器主要有分液漏斗、烧杯
D.在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为CoO