题目内容
【题目】电化学在化学工业有着广泛的应用,
(1)工业冶炼铝的化学方程式是;
(2)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换法膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图1所示. 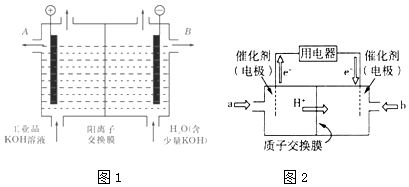
①该电解槽的阳极反应式是;
②除去杂质后的氢氧化钾溶液从液体出口(填写“A”或“B”)导出.
(3)甲醇燃料电池由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注.其工作原理如图2,质子交换膜左右两侧的溶液均为1L 1.5mol/L H2SO4溶液. ①通入气体a的电极是电池的(填“正”或“负”)极,其电极反应式为;
②当电池中有2mol e﹣发生转移时,左右两侧溶液的质量差值为g.
【答案】
(1)2Al2O3(熔融) ![]() 4Al+3O2↑
4Al+3O2↑
(2)4OH﹣﹣4e﹣=2H2O+O2↑; B
(3)负; CH3OH﹣6e﹣+H2O=CO2+6H+;24
【解析】解:(1)工业冶炼铝的化学方程式是2Al2O3(熔融) ![]() 4Al+3O2↑,所以答案是:2Al2O3(熔融)
4Al+3O2↑,所以答案是:2Al2O3(熔融) ![]() 4Al+3O2↑;(2)①该电解槽的阳极反应式是4OH﹣﹣4e﹣=2H2O+O2↑,所以答案是:4OH﹣﹣4e﹣=2H2O+O2↑;
4Al+3O2↑;(2)①该电解槽的阳极反应式是4OH﹣﹣4e﹣=2H2O+O2↑,所以答案是:4OH﹣﹣4e﹣=2H2O+O2↑;
②阳离子向阴极移动,B为除去杂质的KOH,则除去杂质后的氢氧化钾溶液从液体出口B导出,所以答案是:B;(3)①根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH﹣6e﹣+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e﹣+4H+=2H2O,
所以答案是:负;CH3OH﹣6e﹣+H2O=CO2+6H+;
②负极反应式为CH3OH﹣6e﹣+H2O=CO2+6H+,当转移2mol电子时,左侧质量减轻 ![]() ×2×(44﹣32)g=4g,还要有2molH+通过质子交换膜进入右侧,质量减少2g,正极反应式为O2+4H++4e﹣=2H2O,右侧质量增加32g×
×2×(44﹣32)g=4g,还要有2molH+通过质子交换膜进入右侧,质量减少2g,正极反应式为O2+4H++4e﹣=2H2O,右侧质量增加32g× ![]() ×2=16g,加上转移过来的2gH+,因此左右两侧溶液的质量之差为16g+2g+4g+2g=24g,
×2=16g,加上转移过来的2gH+,因此左右两侧溶液的质量之差为16g+2g+4g+2g=24g,
所以答案是:24.

 快乐5加2金卷系列答案
快乐5加2金卷系列答案