��Ŀ����
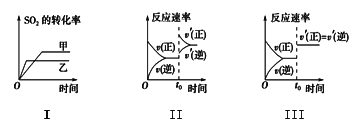
����Ŀ��25��ʱ����Ũ�Ⱦ�Ϊ0.1mol/L�������ͬ��HA��Һ��BOH ��Һ��ϣ�������Һ�������Ϊ100 mL,��Һ���������ҺpH �Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A. V1��ʾHA ��Һ�������V2��ʾBOH ��Һ�����
B. Ka( HA) ��Kb( BOH) ����������ȣ���Ϊ10-6
C. y��ʱ��c(B+)=c(A-)=c(OH-)=c(H+)
D. x��y��z ��ʾ����ʱˮ�ĵ���̶�:y>x=z
���𰸡�D
��������A. ����ͼ��HA��Һ��BOH��Һ��������ʱ����Һ��pH=7������V1��������Һ��pH������˵��V1��ʾBOH��Һ���������V2��ʾHA��Һ���������A����B. ����ͼ��HA��Һ��BOH��Һ��������ʱ����Һ��pH=7��˵����Һ�����ԣ�˵��Ka(HA)��Kb(BOH)��ȣ�0.1mol/L HA��ҺpH=3����Ka(HA)=![]() ��10-5����B����C. y��ʱ����Һ��pH=7��˵����Һ�����ԣ�����Ϊ�������ӵ�ˮ��̶���ͬ�����c(B+)=c(A-)��c(OH-)=c(H+)����C����D. x��z�������Ũ����ȣ���ΪKa(HA)��Kb(BOH)��ȣ���ˮ�ĵ�������Ƴ̶���ȣ�y���ε�Ũ�����ˮ�ĵ���Ĵٽ��̶��������ʱˮ�ĵ���̶�:y>x=z����D��ȷ����ѡD��
��10-5����B����C. y��ʱ����Һ��pH=7��˵����Һ�����ԣ�����Ϊ�������ӵ�ˮ��̶���ͬ�����c(B+)=c(A-)��c(OH-)=c(H+)����C����D. x��z�������Ũ����ȣ���ΪKa(HA)��Kb(BOH)��ȣ���ˮ�ĵ�������Ƴ̶���ȣ�y���ε�Ũ�����ˮ�ĵ���Ĵٽ��̶��������ʱˮ�ĵ���̶�:y>x=z����D��ȷ����ѡD��

 �ظ���ʦ�㲦ϵ�д�
�ظ���ʦ�㲦ϵ�д�