题目内容
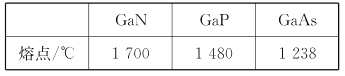
【题目】在下列各微粒中,能使水的电离平衡向电离的方向移动,且使溶液的pH<7的是( )
A.![]() B.HCO3-C.HSO4-D.K+
B.HCO3-C.HSO4-D.K+
【答案】A
【解析】
的电离是吸热的,存在电离平衡H2O![]() H++OH-,要使平衡正向移动,应减小溶液中c(H+)或c(OH-),使溶液的pH<7,说明溶液显酸性,据此分析判断。
H++OH-,要使平衡正向移动,应减小溶液中c(H+)或c(OH-),使溶液的pH<7,说明溶液显酸性,据此分析判断。
A. 由示意图可知该微粒为Al3+,能结合水电离出的OH-,使水的电离平衡正向移动,且能使溶液显酸性,A项正确;
B. HCO3-为弱酸的酸式酸根,既能电离又能水解,且水解程度大于电离程度,能促进水的电离,水解后使溶液显碱性,B项错误;
C. HSO4-是强酸的酸式酸根,电离后生成H+和SO42-,使溶液呈酸性,且抑制水的电离,C项错误;
D. K+是强碱的阳离子,不能水解,对水的电离平衡没有影响,溶液显中性,D项错误;
答案选A。

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目