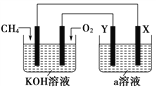
题目内容
【题目】在一隔热系统中,初始温度为25℃,向20.00mL0.1000mol/L的氨水溶液中逐滴加入0.1000mol/L的HCl溶液,测得混合溶液的温度变化如图。下列相关说法正确的是
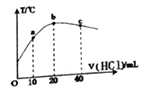
A. a、b、c点的水的电离程度依次增大
B. 判断溶液的pH:b点pH=7,c点pH<7
C. 己知25℃时0.2mol/L氨水电离度为1.33%,此时氨水的pH 约为12
D. 若a点溶液呈碱性,则a点有c(NH4+)>c(Cl-)>c(NH3·H2O)
【答案】D
【解析】A. b点恰好反应生成氯化铵,铵根水解,促进水的电离,且溶液温度最高,而酸或碱抑制水的电离,所以水的电离程度最大的是b点,A错误;B. 恰好反应时放热最多,加热促进水的电离,铵根水解,促进水的电离,则溶液的pH:b点pH<7,c点盐酸过量:pH<7,B错误;C. 己知25℃时0.2mol/L氨水电离度为1.33%,此时氨水溶液中氢氧根浓度是0.2mol/L×1.33%=0.00266mol/L,所以pH>12,C错误;D. 若a点溶液呈碱性,说明铵根的水解程度小于一水合氨的电离程度,则a点有c(NH4+)>c(Cl-)>c(NH3·H2O),D正确,答案选D。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案【题目】依据下表有关铁难溶化合物的溶度积,有关说法正确的是
化合物 | 溶度积(25℃) | 化合物 | 溶度积(25℃) |
FeCO3 | 3.2×10-11 | Fe(OH)3 | 4.0×10-38 |
Fe(OH)2 | 8.0×10-11 | FeS | 6.3×10-18 |
A. 在c(CO32-)=0.1 mol·L-1的溶液中,c(Fe2+)≥3.2×10-10 mol·L-1
B. 将FeCl3和 FeCl2溶液分别调至PH=10,则c(Fe2+)< c(Fe3+)
C. 增加溶液的酸性,有利于将Fe2+沉淀为FeS和FeCO3
D. 将反应液中的Fe2+氧化为 Fe3+有利于将铁从溶液中除尽