题目内容
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)元素B、C、D的第一电离能的由大到小排列顺序为 。(用元素符号表示)
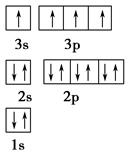
(2)D元素原子的最外层电子排布图为 。
(3)该配位化合物的化学式为 ,配体的中心原子的杂化方式为 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(5)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 ,分子中含有 个s键, 个p键。
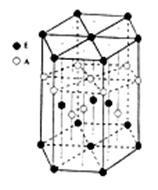
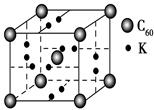
(6)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。则该化合物的 化学式为 。该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。
(1)元素B、C、D的第一电离能的由大到小排列顺序为 。(用元素符号表示)
(2)D元素原子的最外层电子排布图为 。
(3)该配位化合物的化学式为 ,配体的中心原子的杂化方式为 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(5)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 ,分子中含有 个s键, 个p键。
(6)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。则该化合物的 化学式为 。该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。

(1)N>O>S (2分) (2)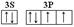 (1分)
(1分)
(3)Cu(NH3)4SO4×H2O (1分) sp3杂化(1分) (4)H2O与H2O2之间形成氢键(2分)
(5)H-N=N-H (2分) 3(1分) 1(1分)
(6)CuH(2分) 2CuH+3Cl2 2CuCl2+2HCl(2分)
2CuCl2+2HCl(2分)
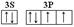 (1分)
(1分)(3)Cu(NH3)4SO4×H2O (1分) sp3杂化(1分) (4)H2O与H2O2之间形成氢键(2分)
(5)H-N=N-H (2分) 3(1分) 1(1分)
(6)CuH(2分) 2CuH+3Cl2
 2CuCl2+2HCl(2分)
2CuCl2+2HCl(2分)试题分析:原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,判断D是S、C是O;E元素的外围电子排布为(n-1)dn+6nsl,n-1≥3,0<n+6≤10,n=4,故E是Cu。A在比例中相对很多,可能是H元素;将H、O、S、Cu(蓝色)的化合价+1、-2、+6、+2带入比例组成的H14B4O5SCu中,B为-3价,在O元素之前,是N元素。

练习册系列答案
相关题目


 和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
 键
键