题目内容
(12 分)揖选做题铱本题包括A、B 两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A 小题评分。
A. [物质结构与性质]
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为 。
②NO3- 的空间构型是 (用文字描述)。
(2)在铜锰氧化物的催化下,CO 被氧化为CO2,HCHO 被氧化为CO2和H2O。
①根据等电子体原理,CO 分子的结构式为 。
②H2O 分子中O 原子轨道的杂化类型为 。
③1 mol CO2中含有的σ键数目为 。
(3) 向CuSO4溶液中加入过量NaOH 溶液可生成[Cu (OH)4 ]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 。
A. [物质结构与性质]
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为 。
②NO3- 的空间构型是 (用文字描述)。
(2)在铜锰氧化物的催化下,CO 被氧化为CO2,HCHO 被氧化为CO2和H2O。
①根据等电子体原理,CO 分子的结构式为 。
②H2O 分子中O 原子轨道的杂化类型为 。
③1 mol CO2中含有的σ键数目为 。
(3) 向CuSO4溶液中加入过量NaOH 溶液可生成[Cu (OH)4 ]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 。
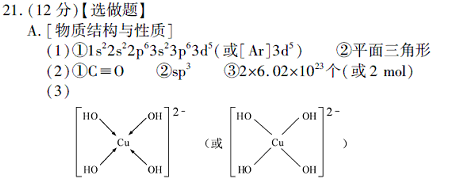
(1)Mn原子序数为25,价电子排布为3d54s2,先失去4s上二个电子,即得Mn2+。NO3- 离子中氮原子无孤对电子,配位原子为3,则N采用sp2杂化,所以NO3- 的空间构型为平面三角形。(2)CO与N2互为等电子体,根据氮分子的结构式可以写出CO的结构式为C≡O。H2O中O原子存在两对孤对电子,配位原子为2,价电子对为4,所以O原子采用sp3杂化。二氧化碳分子内含有碳氧双键,双键中有一个为?键,一个为?键,则1molCO2中含有2mol?键。(3)Cu2+中存在空轨道,而OH-中O原子上面有孤对电子,故O与Cu之间以配位键结合。
【考点定位】电子排布式,空间构型,杂化方式,化学键的数法以及配位键的表示
【考点定位】电子排布式,空间构型,杂化方式,化学键的数法以及配位键的表示

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目

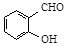 )和对羟基苯甲醛(
)和对羟基苯甲醛(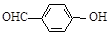 )的沸点
)的沸点