题目内容
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)甲醇熔融碳酸盐电池是一种新型燃料电池,该电池以熔融的Na2CO3为电解质,写出该电池负极的电极反应式:_____________________________
(2)恒容条件下,能表明反应I达到化学平衡状态的是________。
a.混合气体的密度不变 b.反应容器中甲醇的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)反应Ⅱ的△H2=__________。
(4)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,温度为500℃时,该反应10 min时达到平衡,CO2的平衡转化率为60℅,用H2表示该反应的速率为____________。
(5)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示。
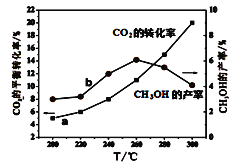
据图可知当温度高于260℃后,CO的浓度随着温度的升高而_________(填“增大”、“减小”、“不变”或“无法判断”)。
【答案】 CH3OH- 6e- + 3CO32- =4CO2+2H2O bd +41.19 kJmol-1 0.135 mol·L-1·min-1 增大
【解析】(1)甲醇燃料电池的负极为甲醇失电子的反应,方程式为:CH3OH- 6e- + 3CO32- =4CO2+2H2O
(2)a.恒容条件下,气体的密度等于气体总质量除以总体积,气体总质量不变,总体积也不变,所以密度始终不变,不能作为反应达到平衡的标志,故a错误;b. 甲醇的百分含量不变,说明各组分浓度不再变化,反应达到平衡,故b正确;c.各组分的正反应速率比始终等于化学计量数之比,故C错误;d.对于反应前后气体物质的量变化的反应,压强随着反应改变,当反应达平衡时,压强不再改变,故d正确;本题选bd。
(3)反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=49.58kJmol1,反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g)△H2,反应Ⅲ:CO(g)+2H2(g)CH3OH(g)△H3=90.77kJmol1,根据盖斯定律:Ⅱ=ⅠⅢ得反应②的△H2=+41.19kJmol1。
(4)O2(g)+3H2(g)CH3OH(g)+H2O(g)
初起量:1.5mol3mol00
变化量:0.9mol2.7mol0.9mol0.9mol
平衡量:0.6mol0.3mol0.9mol0.9mol
v=(2.7/2)/10=0.135molL1min1,故答案为:0.135molL1min1;
(5)反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO,所以当温度高于260℃后,CO的浓度一定增大,故答案为:增大。

 走进文言文系列答案
走进文言文系列答案