题目内容
【题目】V2﹣、W3﹣、X2+、Y2﹣、Z﹣是由短周期元素形成的简单离子,其中V2﹣、W3﹣、X2+均是10电子的微粒,Y2﹣、Z﹣与Ar原子具有相同的电子数。(请用化学用语回答下列问题)
(1)V2﹣的离子结构示意图为_________________。
(2)V、W、X的原子半径由小到大的顺序是________________。
(3)元素Y、Z气态氢化物的热稳定性比较(填化学式):______________。
(4)将Z的单质通入石蕊溶液中发生的颜色变化如下图,请在方框内填写出导致该阶段颜色变化的主要粒子符号。________、________、________。

【答案】![]() O、N、Mg HCl>H2S H+ HClO Cl2
O、N、Mg HCl>H2S H+ HClO Cl2
【解析】
V2-、W3-、X2+、Y2-、Z-是由短周期元素形成的简单离子,V2-、W3-、X2+均是10电子的微粒,则V为O元素、W为N元素、X为Mg元素;Y2-、Z-与Ar原子具有相同的电子数,则Y为S元素、Z为Cl元素,据此分析解答。
由上述分析可知,V为O、W为N、X为Mg、Y为S、Z为Cl。
(1)O2-的结构示意图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)原子半径的变化规律:同一周期,自左而右,原子半径逐渐减小;同一主族自上而下,原子半径逐渐增大,所以V、W、X的原子半径由小到大的顺序是O、N、Mg,故答案为:O、N、Mg;
(3)元素的非金属性越强,对应氢化物的越稳定,非金属性Y<Z,气态氢化物的热稳定性H2S <HCl,故答案为:H2S <HCl;
(4)将氯气通入紫色石蕊溶液中,氯气与水反应生成盐酸和次氯酸,溶液显酸性,紫色石蕊溶液变成红色;次氯酸具有漂白性,然后溶液又褪色;最后氯气溶于水,形成饱和氯水,溶液呈现黄绿色,故答案为:H+;HClO;Cl2。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| I | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的 H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验I中铁主要发生了析氢腐蚀,其负极反应式是__________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其理论判断依据是__________;
乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是__________。
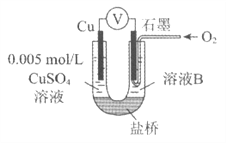
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
V | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验II、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是__________。
②丁同学对Ⅳ、V进行比较,其目的是探究__________对O2氧化性的影响。
③实验Ⅳ中加入Na2SO4溶液的目的是__________。
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、V重复进行实验,其设计意图是__________;重复实验时,记录电压表读数依次为c'、d',且c'>d',由此得出的结论是__________。
【题目】生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应)。
【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在。
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计。
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化。
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)。
实验序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
③ | ________ | 7 | 60 | ______ | ______ | 10 |
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示。
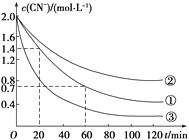
(2)实验①中20~60 min时间段反应速率:v(CN-)=______mol·L-1·min-1。
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是____________________(填一点即可)。在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO,同时放出NH3,试写出该反应的离子方程式:____________。
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他们设计实验并验证上述结论,完成下表中内容(已知:废水中的CN-浓度可用离子色谱仪测定) ______。
实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |