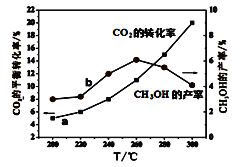
��Ŀ����
����Ŀ��ij����(Cr2O72-)��ˮ�����������[FeSO4��(NH4)2SO4��6H2O]��������Ӧ����Ԫ�غ�Ԫ����ȫת��Ϊ�������ó����������õ�n mol FeO��FeyCrxO3�������Ǵ��������е�ʵ����ģ����������������(����)
A. ������ˮ��Cr2O72-�����ʵ���Ϊnx/2mol
B. ������������淋����ʵ���Ϊn(2��x)mol
C. ��Ӧ�з���ת�Ƶĵ��������ʵ���Ϊ3nxmol
D. ��FeO��FeyCrxO3��3x��y
���𰸡�B
��������
���ݻ��ϼ۴�����Ϊ�㣬FeO��FeyCrxO3��3y+3x=6���ɵ�ʧ�����غ㣬��3x=y����Ϊ��Ӧ����Ԫ�غ�Ԫ����ȫת��Ϊ���������ݹ�ϵʽΪ��Cr2o72-![]() 2 Cr
2 Cr![]() 6e, Fe2+
6e, Fe2+![]() Fe2+
Fe2+![]() e��Ҫ�õ�n mol FeO��FeyCrxO3����ҪCr2O72-�����ʵ���Ϊny/6mol, �ɵ�ʧ�����غ㣬��3x=y, Cr2O72-�����ʵ���Ϊnx/2mol,�� A��ȷ��B.����ԭ���غ�n mol FeO��FeyCrxO3��������������淋����ʵ���Ϊ��n(1+y)mol= n(3x+1)mol, ��B�������C�nx/2 Cr2O72-��Ӧ��ת�Ƶ���3nxmol ����C����ȷ��D��ɵ�ʧ�����غ㣬��3x=y ����D����ȷ���𰸣�B��
e��Ҫ�õ�n mol FeO��FeyCrxO3����ҪCr2O72-�����ʵ���Ϊny/6mol, �ɵ�ʧ�����غ㣬��3x=y, Cr2O72-�����ʵ���Ϊnx/2mol,�� A��ȷ��B.����ԭ���غ�n mol FeO��FeyCrxO3��������������淋����ʵ���Ϊ��n(1+y)mol= n(3x+1)mol, ��B�������C�nx/2 Cr2O72-��Ӧ��ת�Ƶ���3nxmol ����C����ȷ��D��ɵ�ʧ�����غ㣬��3x=y ����D����ȷ���𰸣�B��

��ϰ��ϵ�д�
�����Ŀ