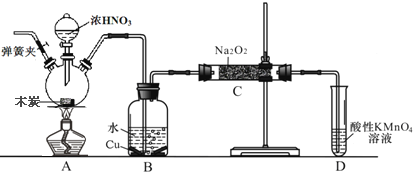
��Ŀ����
����Ŀ��ij����������ɰ�����в����Ĺ�����ϣ���Ҫ����MgCO3��MgSiO3��CaMg(CO3)2��A12O3��Fe2O3�ȣ���������þ�Ĺ�����������:

������ | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
pH | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
����������������������ʽ��ȫ���ʱ��Һ��pH �ɼ��ϱ�
��1���������������У�Ϊ���þ�Ľ����ʣ��ɲ�ȡ�Ĵ�ʩ��_____________________(Ҫ��д������)
��2������I����Ҫ�ɷ���_________________________��
��3������ҺII�пɻ������õ���Ҫ������________________________��
��4�������յõ����Ȼ�þ��Һ�У�c(Mg2+)=0.02 mol��L-1������˫��ˮ������(����Һ�������1��)��ʹFe3+ǡ�ó�����ȫ����Һ��c(Fe3+)=1.0��10-5 mol��L-1 ����ʱ�Ƿ���Mg3(PO4)2��������?_______(��ʽ����)��FePO4��Mg3(PO4)2��Ksp�ֱ�Ϊ1.3��10-22��1.0��10-24��
��5�� Mg (C1O3)2��ũҵ�Ͽ�������Ҷ������������ɲ��ø��ֽⷴӦ�Ʊ�: MgCl2+2NaC1O3=Mg (C1O3)2+2NaCl��֪���ֻ�������ܽ��(S) ���¶�(T) �仯��������ͼ��ʾ: �ٽ���Ӧ�ﰴ��ѧ��Ӧ����ʽ�������Ȼ���Ʊ�Mg (ClO3)2���������Ʊ�Mg (ClO3)2��ԭ��:_______________________��
�ڰ��������������Ʊ�ʵ�顣����ȴ��������Mg (ClO3)2�����У�������NaCl ������ԭ����:__________����ȥ��Ʒ�и����ʵķ�����:___________________________________________��

���𰸡� �ʵ���߷�Ӧ�¶ȡ����衢���ӽ���ʱ�䡢���˺�����Һ�мӹ���ϡ���ᣨ��ν�ȡ�� Al��OH)3��Fe��OH)3 Na2SO4 Fe3+ǡ�ó�����ȫʱ��c(PO43-)=![]() mol��L1=1.3��10�C17 mol��L1��c3(Mg2+)��c2(PO43-)��(0.01)3��(1.3��10�C17)2=1.7��10�C40��Ksp [Mg3(PO4)2]����˲�������Mg3(PO4)2���� ��ijһ�¶�ʱ��NaCl���ȴﵽ����������Mg��ClO3)2���ܽ�����¶ȵı仯���NaCl�ܽ�����������ʵ��ܽ����һ����� ����ǰ����Һ��NaCl�ѱ��ͣ����¹����У�NaCl�ܽ�Ƚ��ͣ����������� �ؽᾧ
mol��L1=1.3��10�C17 mol��L1��c3(Mg2+)��c2(PO43-)��(0.01)3��(1.3��10�C17)2=1.7��10�C40��Ksp [Mg3(PO4)2]����˲�������Mg3(PO4)2���� ��ijһ�¶�ʱ��NaCl���ȴﵽ����������Mg��ClO3)2���ܽ�����¶ȵı仯���NaCl�ܽ�����������ʵ��ܽ����һ����� ����ǰ����Һ��NaCl�ѱ��ͣ����¹����У�NaCl�ܽ�Ƚ��ͣ����������� �ؽᾧ
��������MgCO3��MgSiO3��CaMg(CO3)2��Al2O3��Fe2O3�������ᷴӦ��������MgSO4��CaSO4��Al2(SO4)3��Fe2(SO4)3��H2SiO3������CaSO4�ܡ�H2SiO3���ܣ��γ���������Һ�к���MgSO4��Al2(SO4)3��Fe2(SO4)3������Һ�м���NaOH��Һ������pH��5.5ʱ��Fe3+��Al3+�Ѿ���ȫ����������I����Ҫ�ɷ���Fe(OH)3��Al(OH)3����Һ�к���MgSO4��Na2SO4������Һ�м���NaOH��������Һ��pHΪ12.5��þ��������Mg(OH)2���������˵õ���ҺNa2SO4��Һ������������þ���پ���һϵ�з�Ӧ�õ��Ȼ�þ��
(1)�������������У������¶ȡ����衢����Ӧ��Ӵ�ʱ�䶼�����þ�Ľ����ʣ�����Ϊ�����þ�Ľ�ȡ�ʣ����Բ��������¶ȡ����衢��ν�ȡ�ȷ������ʴ�Ϊ�������¶ȡ����衢��ν�ȡ�ȣ�
(2)����I�����ӡ��������γɵ����������������������I�ijɷ�ΪFe(OH)3 Al(OH)3���ʴ�Ϊ��Fe(OH)3 Al(OH)3��
(3)����Һ���е����ʺ��������ƣ����Կ��Ի������õ�����ΪNa2SO4���ʴ�Ϊ��Na2SO4��
(4)Fe3+ǡ�ó�����ȫ����Һ��c(Fe3+)=1.0��10-5����Ksp(FePO4)����֪c(PO43-)=![]() =1.0��10-17mol/L��Qc[Mg3(PO4)2]=(
=1.0��10-17mol/L��Qc[Mg3(PO4)2]=( ![]() )3��(1.0��10-17mol/L)2=1.7��10-40��Ksp=1.0��10-24�����������ɣ��ʴ�Ϊ��Fe3+ǡ�ó�����ȫʱ��Qc[Mg3(PO4)2]��Ksp [Mg3(PO4)2]����˲�������Mg3(PO4)2������
)3��(1.0��10-17mol/L)2=1.7��10-40��Ksp=1.0��10-24�����������ɣ��ʴ�Ϊ��Fe3+ǡ�ó�����ȫʱ��Qc[Mg3(PO4)2]��Ksp [Mg3(PO4)2]����˲�������Mg3(PO4)2������
(5)�ٷ�ӦMgCl2+2NaClO3�TMg(ClO3)2+2NaCl�����ں�°��Ƽ����NaHCO3��ԭ������ΪNaCl�ܽ��С������Һ��������ʹ��Ӧ������Mg(ClO3)2�ķ�����У��ʴ�Ϊ����ijһ�¶�ʱ��NaCl���ȴﵽ����������Mg(ClO3)2���ܽ�����¶ȵı仯���NaCl�ܽ�����������ʵ��ܽ����һ�����
���ڽ��µĹ����У�Mg(ClO3)2���ܽ�Ȳ��ϼ�С������Һ����������ͬ�¶�ʱ�Ȼ��Ƶ��ܽ����С���������ȴ��������Mg(ClO3)2������һ���������Ȼ��ƣ�����������Mg(ClO3)2�Ĺ�����NaClҲ�������ɣ�ͨ���ᾧ���ؽᾧ�ķ����ᴿ�������壻�ʴ�Ϊ������ǰ����Һ��NaCl�ѱ��ͣ����¹����У�NaCl�ܽ�Ƚ��ͣ��������������ؽᾧ��

����Ŀ���±����Ǹ��鷴Ӧ�ķ�Ӧ����¶ȣ���Ӧ�տ�ʼʱ���ų�H2���������ǣ�������
��������ĩ״��/mol | ���Ũ�ȼ���� | ��Ӧ�¶� | |||
A | Mg | 0.1 | 6molL��1���� | 10mL | 60�� |
B | Mg | 0.1 | 3molL��1���� | 10mL | 60�� |
C | Fe | 0.1 | 3molL��1���� | 10mL | 60�� |
D | Mg | 0.1 | 3molL��1���� | 10mL | 60�� |
A.A
B.B
C.C
D.D