题目内容
【题目】以铜为原料可制备应用广泛的氧化亚铜。
(1)向CuCl2溶液中通入SO2可得到CuCl沉淀,由CuCl水解再热分解可得到纳米Cu2O。CuCl水解为:CuCl(s)+H2O(l)![]() CuOH(s)+Cl-(aq)+H+(aq)。
CuOH(s)+Cl-(aq)+H+(aq)。
该反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____________。
(2)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图所示。
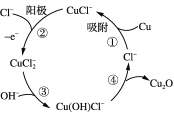
①阳极(反应②)的电极反应式为________________________________。
②电解一段时间后,电解液补充一定量的__________可完全恢复成原电解质溶液(填化学式)。
③溶液中③、④二步总反应的离子方程式为____________________________________。
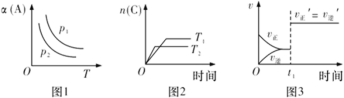
(3)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇: CO(g)+2H2(g)![]() CH3OH(g) ΔH=a kJ· mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH=a kJ· mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
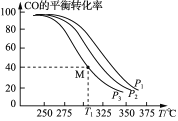
①该反应的ΔH_____0(填“<”或“>”),图中压强P1、P2、P3由大到小的关系是__________;
②起始时,甲容器中c(H2)=0.20 mol·L-1,c(CO)=0.10 mol·L-1,在P3及T1℃下反应达到平衡,此时反应的平衡常数为______(保留三位有效数字)。起始时,乙容器中c(H2)=0.40 mol·L-1,c(CO)=0.20 mol·L-1,T1℃下反应达到平衡,CO的平衡转化率______(填字母)。
A.大于40% B.小于40% C.等于40% D.等于80%
【答案】Kw×Ksp(CuCl)/Ksp(CuOH) CuCl--e-+Cl-=CuCl2 H2O 2CuCl2+2OH-=Cu2O↓+H2O+4Cl- < P1>P2>P3 46.3 A
【解析】
本题是一道综合题,以铜为载体考察了化学动力学、电化学的相关知识,难度一般。
(1)![]() ,
,![]() ,
,![]() ,
, ![]() ,因此很自然地可以看出
,因此很自然地可以看出![]() ;
;
(2)①据图可以看出,反应②中![]() 失去电子变成
失去电子变成![]() ,因此电极反应式为:
,因此电极反应式为:![]() ;
;
②据图可以发现,该电解池中仅仅消耗了水,根据“少谁补谁”的原则,只需向溶液中补充一定量的水就可完全恢复成原电解质溶液;
③第三步的方程为![]() ,第四步的方程为
,第四步的方程为![]() ,将两个方程式按2:1加和即得总反应方程式:
,将两个方程式按2:1加和即得总反应方程式:![]() ;
;
(3)①由图可以看出,温度越高则转化率越低,反应进行得越不彻底,因此正反应为放热反应;因为该反应是一个气体分子数减小的反应,所以压强越大反应得越彻底,根据图中可以看出:当温度相同时P1进行得最彻底,所以P1 > P2 > P3;
②已知条件下一氧化碳的转化率为40%,则达到平衡时一氧化碳的浓度为0.06mol/L,二氧化碳的浓度为0.12mol/L,甲醇的浓度为0.04mol/L,代入![]() =
=![]() =46.3;该体系是一个恒容体系,乙容器可以理解为甲容器达到平衡后再向容器中充入一定量的氢气和一氧化碳,装置内的压强增大后平衡会正向移动,所以乙装置中的平衡转化率将大于甲,大于40%。
=46.3;该体系是一个恒容体系,乙容器可以理解为甲容器达到平衡后再向容器中充入一定量的氢气和一氧化碳,装置内的压强增大后平衡会正向移动,所以乙装置中的平衡转化率将大于甲,大于40%。

 名校课堂系列答案
名校课堂系列答案