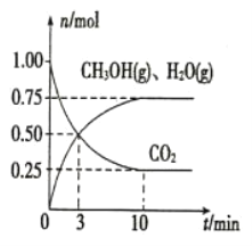
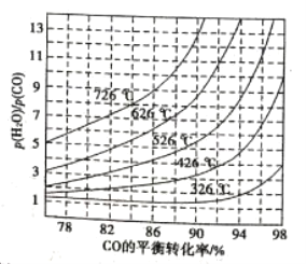
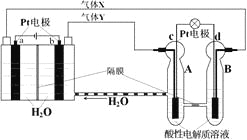
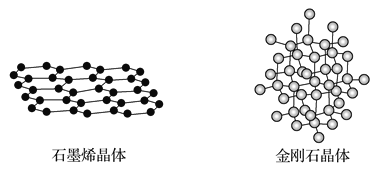
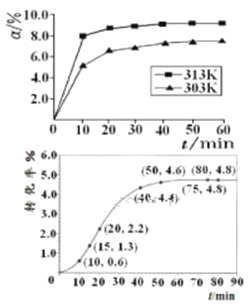
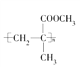
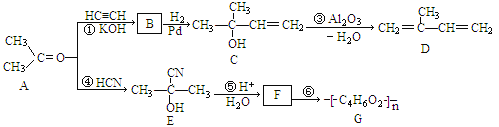
ЬтФПФкШн
ЁОЬтФПЁПРћгУЁАМлРрЖўЮЌЭМЁБбаОПЮяжЪЕФаджЪЪЧЛЏбЇбаОПЕФживЊЪжЖЮЁЃШчЭМЪЧТШдЊЫиЕФЛЏКЯМлгыВПЗжЮяжЪРрБ№ЕФЖдгІЙиЯЕЁЃ
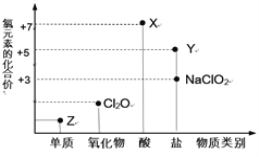
ЛиД№ЯТСаЮЪЬтЃК
(1)XЕФЕчРыЗНГЬЪНЮЊ_________ЁЃ
(2)ТШЕФФГжжбѕЛЏЮя(ClmOn)жаТШЁЂбѕдЊЫижЪСПБШЮЊ71:48ЃЌдђm:n= _________ЁЃ
(3) NaClOгаНЯЧПЕФбѕЛЏадЃЌЫљвдЪЧГЃгУЕФЯћЖОМСКЭЦЏАзМСЃЌЧыаДГіЙЄвЕЩЯгУТШЦјКЭNaOHШмвКЩњВњЯћЖОМСNaClOЕФРызгЗНГЬЪН_____________ЁЃ
(4)NaClO2ОпгаКмЧПЕФбѕЛЏадЃЌГЃгУзїЯћЖОМСЃЌЦфЯћЖОаЇТЪЪЧZЕФ ___________БЖ(ЛЙдВњЮяЖМЮЊCl-ЃЌЯћЖОаЇТЪвдЕЅЮЛЮяжЪЕФСПЕУЕНЕФЕчзгЪ§БэЪО)ЁЃ
(5)Cl2OПЩгУГБЪЊЕФZгыNa2CO3ЗДгІжЦШЁЃЌЭЌЪБЩњГЩNaHCO3ЃЌЗДгІжаZМШЬхЯжбѕЛЏадЃЌгжЬхЯжЛЙдадЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_____________ЁЃ
(6)здРДЫЎжаЕФ![]() ЖдШЫРрНЁПЕВњЩњЮЃКІЁЃЮЊСЫНЕЕЭздРДЫЎжа
ЖдШЫРрНЁПЕВњЩњЮЃКІЁЃЮЊСЫНЕЕЭздРДЫЎжа![]() ЕФХЈЖШЃЌФГбаОПШЫдБЬсГідкМюадЬѕМўЯТгУAlЗлЛЙд
ЕФХЈЖШЃЌФГбаОПШЫдБЬсГідкМюадЬѕМўЯТгУAlЗлЛЙд![]() ЃЌВњЮяЪЧN2ЁЃЗЂЩњЕФЗДгІПЩБэЪОШчЯТЃЌЧыЭъГЩЗНГЬЪНЕФХфЦНЃК___Al+ ____
ЃЌВњЮяЪЧN2ЁЃЗЂЩњЕФЗДгІПЩБэЪОШчЯТЃЌЧыЭъГЩЗНГЬЪНЕФХфЦНЃК___Al+ ____![]() + _____=___
+ _____=___![]() + _____ N2Ёќ + _______H2O
+ _____ N2Ёќ + _______H2O
ЁОД№АИЁПHClO4=H++![]() 2:3 Cl2+2OH=Cl+ClO+H2O 2 2Cl2+2Na2CO3+H2O =2NaHCO3 +2NaCl+Cl2O 10 6 4OH 10 3 2
2:3 Cl2+2OH=Cl+ClO+H2O 2 2Cl2+2Na2CO3+H2O =2NaHCO3 +2NaCl+Cl2O 10 6 4OH 10 3 2
ЁОНтЮіЁП
ИљОнТШдЊЫиЫљГЪЯжЕФЛЏКЯМлПЩжЊЃЌЕЅжЪZЮЊCl2ЃЌXЮЊ+7МлТШдЊЫиЕФКЌбѕЫсЮЊHClO4ЃЌYЮЊNaClO3ЕШТШЫсбЮЁЃ
(1)XЮЊHClO4ЃЌЮЊЧПЫсЃЌПЩвдЭъШЋЕчРыЃЌЫљвдЕчРыЗНГЬЪНЮЊHClO4=H++![]() ЃЛ
ЃЛ
(2)ТШЕФФГжжбѕЛЏЮя(C1mOn)жаТШЁЂбѕдЊЫижЪСПБШЮЊ71ЃК48ЃЌдђmЃКn=![]() =2:3ЃЛ
=2:3ЃЛ
(3)ТШЦјКЭNaOHШмвКЗДгІЩњГЩДЮТШЫсФЦЁЂТШЛЏФЦКЭЫЎЃЌРызгЗНГЬЪНЮЊCl2+2OHЁЅ=ClЁЅ+ClOЁЅ+H2OЃЛ
(4)ZЮЊCl2ЃЌ1molCl2БЛЛЙдГЩClЁЅзЊвЦ2molЕчзгЃЌ1molNaClO2БЛЛЙдГЩClЁЅзЊвЦ4molЕчзгЃЌЫљвдNaClO2ЕФЯћЖОаЇТЪЪЧТШЦјЕФ2БЖЃЛ
(5)ГБЪЊЕФCl2гыNa2CO3ЛьКЯжЦШЁЩйСПCl2OЕФЗДгІжаЃЌCl2МШЬхЯжСЫбѕЛЏадЃЌвВЬхЯжСЫЛЙдадЃЌдђИУЗДгІжаЩњГЩТШЛЏФЦЁЂCl2OКЭЬМЫсЧтФЦЃЌЗДгІЗНГЬЪНЮЊЃК2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2OЃЛ
(6)ИљОнЬтФПЫљИјаХЯЂПЩжЊAlдкМюадЛЗОГЯТБЛЯѕЫсИљбѕЛЏГЩ![]() ЃЌЛЏКЯМлЩ§Ип3МлЃЌ
ЃЌЛЏКЯМлЩ§Ип3МлЃЌ![]() БЛЛЙдГЩN2ЃЌЛЏКЯМлНЕЕЭ5МлЃЌЫљвдAlКЭ
БЛЛЙдГЩN2ЃЌЛЏКЯМлНЕЕЭ5МлЃЌЫљвдAlКЭ![]() ЕФЯЕЪ§БШЮЊ5:3ЃЌМюадШмвКжаOHЁЅВЮгыЗДгІЃЌдйИљОндЊЫиЪиКуПЩЕУРызгЗНГЬЪНЮЊЃК10Al+6
ЕФЯЕЪ§БШЮЊ5:3ЃЌМюадШмвКжаOHЁЅВЮгыЗДгІЃЌдйИљОндЊЫиЪиКуПЩЕУРызгЗНГЬЪНЮЊЃК10Al+6![]() +4OH-=10
+4OH-=10![]() +3N2Ёќ+2H2OЃЌ
+3N2Ёќ+2H2OЃЌ

 ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ
ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИЁОЬтФПЁПШчЭМзАжУПЩгУгкЪеМЏSO2ВЂбщжЄЦфФГаЉЛЏбЇаджЪЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
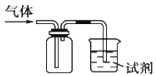
бЁЯю | ЪдМС | ЯжЯѓ | НсТл |
A | ЫсадИпУЬЫсМиШмвК | ШмвКЭЪЩЋ | SO2гаЦЏАзад |
B | ЦЗКьШмвК | ШмвКЭЪЩЋ | SO2габѕЛЏад |
C | ЕЮгаЗгЬЊЕФNaOHШмвК | ШмвКЭЪЩЋ | SO2гаЛЙдад |
D | H2SЫЎШмвК | ШмвКБфЛызЧ | SO2габѕЛЏад |
A.AB.BC.CD.D