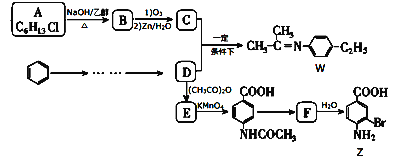
题目内容
【题目】运用化学反应原理研究氮、氯等单质及其化合物的反应有重要意义。
(1)科学家研究在一定条件下通过下列反应制备NH3:
![]()
①在其他条件相同时,反应中NH3的体积分数(a)在不同温度下随反应时间(t)的变化如图。该反应的平衡常数表达式K=______,该反应中的![]() ____0(填“>”“<”或“=”)。
____0(填“>”“<”或“=”)。
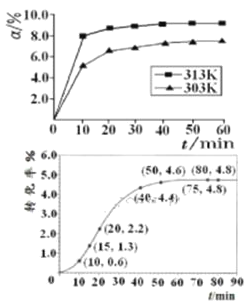
②某温度下,在2L容积不变的密闭容器中加入1molN2和6molH2O(1)发生反应,N2转化率随时间(t)变化如图。15-20min内,v(NH3)=____。若其他条件不变,在图中画出使用催化剂后N2的转化率随反应时间变化的曲线示意图_______。
(2) 25℃时,某同学将0.lmol![]() 盐酸与0.2 mol
盐酸与0.2 mol![]() 氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中c(NH4+)______c(NH3
氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中c(NH4+)______c(NH3![]() H2O)(25℃时,NH3.H2O的电离常数
H2O)(25℃时,NH3.H2O的电离常数![]() )
)
(3) 25℃时,向0.lmol![]() 的MgCl2溶液中逐滴加入适量0.lmol
的MgCl2溶液中逐滴加入适量0.lmol![]() 氨水,有白色沉淀生成,向反应后的浊液中,继续加入0.lmol
氨水,有白色沉淀生成,向反应后的浊液中,继续加入0.lmol![]() 的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,
的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,![]() ,
,![]() )
)
【答案】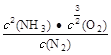 > 0.0018mol·L-1·min-1
> 0.0018mol·L-1·min-1  > > 白色沉淀逐渐变成红褐色 Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+、2Fe3+(aq)+3Mg(OH)2(s)=2Fe(OH)3(s)+3Mg2+(aq)
> > 白色沉淀逐渐变成红褐色 Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+、2Fe3+(aq)+3Mg(OH)2(s)=2Fe(OH)3(s)+3Mg2+(aq)
【解析】
(1)①根据平衡常数的含义,可得该反应的平衡常数K=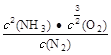 ;根据图像可知,温度升高,生成物NH3的体积分数逐渐增大,说明平衡向右移动,则该反应为吸热反应,H > 0。
;根据图像可知,温度升高,生成物NH3的体积分数逐渐增大,说明平衡向右移动,则该反应为吸热反应,H > 0。
故答案为: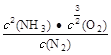 ;>;
;>;
②根据图像,15min时N2的转化率为1.3%,20min时N2的转化率为2%,则v(NH3)=2v(N2)=2×1mol×(2.2%-1.3%)÷2L÷5min=0.0018mol·L-1·min-1;使用了催化剂,反应速率加快,但平衡不移动,可画出曲线如图 。
。
故答案为:0.0018mol·L-1·min-1; ;
;
(2)0.l molL1盐酸与0.2 molL1氨水等体积混合,所得混合溶液含有等量的NH4Cl和NH3H2O,溶液呈碱性,则pH > 7;NH3H2O的电离程度大于NH4Cl的水解程度,所以c(NH4+)>c(NH3H2O)。
故答案为:>;>;
(3)根据Mg(OH)2和Fe(OH)3的Ksp可知生成Fe(OH)3沉淀时OH的浓度更小,所以Mg(OH)2沉淀会转化为Fe(OH)3沉淀,白色沉淀逐渐变成红褐色;先后发生反应的离子方程式为:Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+;2Fe3+(aq)+3Mg(OH)2(s)=2Fe(OH)3(s)+3Mg2+(aq)。
故答案为:白色沉淀逐渐变成红褐色;Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+、2Fe3+(aq)+3Mg(OH)2(s)=2Fe(OH)3(s)+3Mg2+(aq)。