题目内容
【题目】四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A>B>C>D ②四种元素之间形成的某三种分子的比例模型及部分性质如下:
甲:![]() 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二。
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二。
乙:![]() 无色,无气味并且易燃。是常见的一种基础能源。
无色,无气味并且易燃。是常见的一种基础能源。
丙:![]() 有强氧化性的弱酸,可以用于消毒杀菌。
有强氧化性的弱酸,可以用于消毒杀菌。
请根据上述信息回答下列问题。
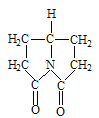
(1)B元素在元素周期表中的位置为________________,请写出BC2分子的电子式:_______________。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂。E单质与甲反应有化合物X生成。请写出以下两个反应的离子方程式:
①A元素的单质与物质甲发生反应:_____________________________________。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生反应:______________________________________________________。
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度丁溶液的试管中,逐滴加入硫酸酸化的硫酸亚铁溶液。滴加过程中的现象为:
①试管中溶液变成深棕黄色,发生反应的离子方程式为 ;
②开始有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,继续滴加溶液,静置一段时间,试管底部出现红褐色沉淀。请回答“片刻后反应变得剧烈”的原因是a b
【答案】(1)第二周期第ⅣA族 ![]()
(2)①Cl2+H2O===H++Cl-+HClO(写可逆号也对) ②Al2O3+2OH-===2AlO+H2O
(3)①2Fe2++H2O2+2H+===2Fe3++2H2O
②a.反应放热,温度升高 b.Fe3+有催化作用(每空1分)
【解析】试题分析:根据题给信息推断,A为氯元素,B为碳元素,C为氧元素,D为氢元素,E为钠元素,F为氯元素,甲为H2O,乙为CH4,丙为HClO,丁为H2O2,X为NaOH。
(1)B为碳元素,在元素周期表中的位置为第二周期第ⅣA族,CO2分子的电子式为![]() 。
。
(2)①氯气与水反应生成盐酸和次氯酸,离子方程式为Cl2+H2O===H++Cl-+HClO ;②Al2O3与氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH-===2AlO+H2O。
(3)①过氧化氢与硫酸酸化的硫酸亚铁溶液反应生成硫酸铁和水,发生反应的离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O;②过氧化氢受热分解生成氧气和水,反应放热、温度升高,生成的Fe3+是过氧化氢分解的催化剂,故片刻后反应变得剧烈。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图1:
己知:A中放有浓硫酸;B中放有9.5mL无水乙醇和6mL冰醋酸;D中放有饱和碳酸钠溶液

有关有机物的沸点.
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:___________________________
(2)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是_______
A.25mL B.50mL C.250mL D.500mL
(3)在步骤①④中都用到沸石防暴沸,下列关于沸石的说法正确的是___
A.实验室沸石也可用碎瓷片等代替
B.如果忘加沸石,可速将沸石加至将近沸腾的液体中
C.当重新进行蒸馏时,用过的沸石可继续使用
D.沸石为多孔性物质,可使液体平稳地沸腾
(4)浓硫酸的作用:催化剂和________; 反应中加入过量的乙醇,目的是_____.
(5)仪器C的名称是____,其作用有冷凝乙酸乙酯和_____,若反应前向D中加入几滴酚酞,溶液呈红色.实验完毕后,将烧杯D中的溶液充分振荡、静止,现象为_____.
(6)现拟分离乙酸乙酯(含少量乙醇和乙酸)粗产品,如图2是分离操作步骤流程图:
则试剂a是:_____,试剂b是:_____.分离方法I是_____,分离方法II是____.
(7)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都先加NaOH溶液中和酯中过量的酸,然后用蒸馏水将酯分离出来.甲、乙两人实验结果如下:甲得到了显酸性的酯的混合物;乙得到了大量水溶性的物质;丙同学分析了上述实验目标产物后认为甲、乙的实验没有成功.试解答下列问题:
①甲实验失败的原因是:________.②乙实验失败的原因是:________.