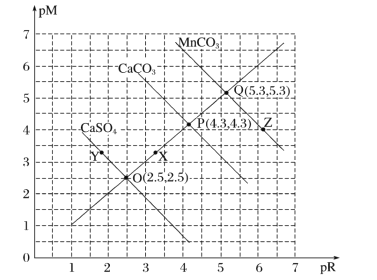
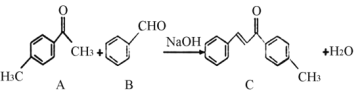
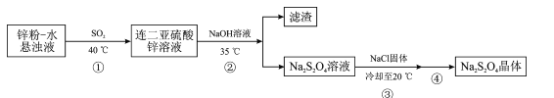
��Ŀ����
����Ŀ��ij��ѧ��ȤС��Ϊ̽��Cl2��Br2��Fe3����������ǿ�������������ʵ�飺
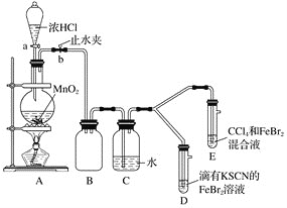
(1)��װ��A�з�����Ӧ�����ӷ���ʽ��____________________��
������ʵ��װ�ô���һ�����ԵIJ��㣬��ָ��__________________��
(2)�ø������װ�ý���ʵ�飬ʵ��������£�_______��
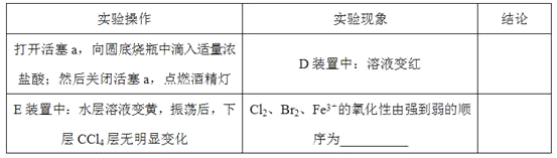
(3)��æ�ڹ۲�ͼ�¼��û�м�ʱֹͣ��Ӧ��D��E�о��������µı仯��Dװ���У���ɫ������ȥ��Eװ���У�CCl4��������ɫ��Ϊ��ɫ������ɫ���ֱ����ɺ�ɫ��
Ϊ̽������ʵ������ı��ʣ�С��ͬѧ����������£�
i.Fe3+3SCN-![]() Fe(SCN)3��һ�����淴Ӧ��
Fe(SCN)3��һ�����淴Ӧ��
ii.(SCN)2������±�ص������ơ������ԣ�Cl2��(SCN)2��
iii.Cl2��Br2��Ӧ����BrCl��BrCl�ʺ�ɫ(�Դ���ɫ)���е�Լ5�棬����ˮ�ܷ���ˮ�ⷴӦ���Ҹ÷�ӦΪ��������ԭ��Ӧ��
iv.AgClO��AgBrO��������ˮ��
����ƽ���ƶ�ԭ��(�����������)����Cl2����ʱD����Һ��ɫ��ȥ��ԭ��_______������Ƽ�ʵ��֤���������ͣ�ȡ������ɫ�����Һ���μ�___________��Һ������Һ��ɫ________�������������Ǻ����ġ�
��̽��E����ɫ�仯��ԭ�����ʵ�����£�
�÷�Һ©�������E���²���Һ�������ռ���ɫ���ʣ�ȡ����������AgNO3��Һ������۲쵽���а�ɫ��������������������������������ʽ(���ӻ�ѧ����ʽ����)���ͽ�������ɫ������ԭ��__________________��
���𰸡�MnO2��4H����2Cl��![]() Mn2����Cl2����2H2O ȱ��β������װ�� Cl2�� Br2�� Fe3�� ����������SCN����Ӧ2SCN����Cl2===2Cl����(SCN)2��ʹSCN��Ũ�ȼ�С����Fe3����3SCN��
Mn2����Cl2����2H2O ȱ��β������װ�� Cl2�� Br2�� Fe3�� ����������SCN����Ӧ2SCN����Cl2===2Cl����(SCN)2��ʹSCN��Ũ�ȼ�С����Fe3����3SCN��![]() Fe(SCN)3ƽ�������ƶ�����ɫ KSCN ���ɫ BrCl��H2O===HBrO��HCl��Ag����Cl��===AgCl��
Fe(SCN)3ƽ�������ƶ�����ɫ KSCN ���ɫ BrCl��H2O===HBrO��HCl��Ag����Cl��===AgCl��
��������
��1����A��Ũ������������̼��ȷ�Ӧ�����Ȼ��̡�������ˮ��
�������ж�����ֱ���ſգ�Ҫ�ü�Һ����β����
��2������a����Բ����ƿ�е�������Ũ���ᣬȻ��رջ���a����ȼ�ƾ��Ƽ��ȣ��������ӵĻ�ԭ�Ա�������ǿ���������������������ӣ������������ӣ�
��3���ٹ���������SCN-��Ӧ��SCN-Ũ�ȼ�С�����������Ӻ���������ӷ�Ӧƽ��ԭ��������
����Һ�м����Ȼ��������軯����Һ������Һ��ɫ�仯�жϣ�
���Ȼ����ܷ���ˮ�ⷴӦ�����ᣬ����AgBrO��AgCl���ܽ��Է�����
��1����Ũ������������̼��ȷ�Ӧ�����Ȼ��̡�������ˮ����Ӧ�����ӷ���ʽΪMnO2��4H����2Cl��![]() Mn2����Cl2����2H2O��
Mn2����Cl2����2H2O��
�����������ж���ֱ���ŷŵ������л���Ⱦ������Ҫ�ü�Һ����β�������ʵ��װ�ô���һ�����ԵIJ���Ϊʵ��װ��ȱ��β������װ�ã�
��2������a����Բ����ƿ�е�������Ũ���ᣬȻ��رջ���a����ȼ�ƾ��Ƽ��ȣ��������ӵĻ�ԭ�Ա�������ǿ���������������������ӣ������������ӣ�����Dװ�������ȱ�죬Eװ����ˮ����Һ��ƣ����²�CCl4�������Ա仯��˵���Ժ��������ӣ�������δ�����������Cl2��Br2��Fe3+����������ǿ������˳��ΪCl2��Br2��Fe3����
��3���ٹ���������SCN-��Ӧ2SCN-+Cl2��2Cl-+(SCN)2��ʹSCN-Ũ�ȼ�С����ʹƽ��Fe3����3SCN��![]() Fe(SCN)3���淴Ӧ�����ƶ�����ɫ��Ϊ��������ɫԭ���鷽��Ϊ��ȡ������ɫ�����Һ���μ�KSCN��Һ������Һ���ɫ���������Ʋ��������ȡ������ɫ�����Һ���μ�FeCl3��Һ������Һ����죬�������Ʋ������
Fe(SCN)3���淴Ӧ�����ƶ�����ɫ��Ϊ��������ɫԭ���鷽��Ϊ��ȡ������ɫ�����Һ���μ�KSCN��Һ������Һ���ɫ���������Ʋ��������ȡ������ɫ�����Һ���μ�FeCl3��Һ������Һ����죬�������Ʋ������
�ڹ������������巴Ӧ�����Ȼ��壬�Ȼ��岻�ȶ�����ˮ��Ӧ��������ʹ����ᣬBrCl��H2O��HBrO��HCl�������Ӻ������ӷ�Ӧ���ɰ�ɫ�����Ȼ�����Ag����Cl����AgCl����������������ӷ�Ӧ���ɴ�������������ˮ���������ɵİ�ɫ����Ϊ�Ȼ�����