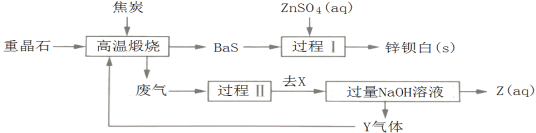
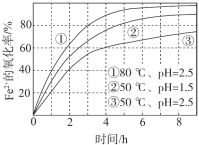
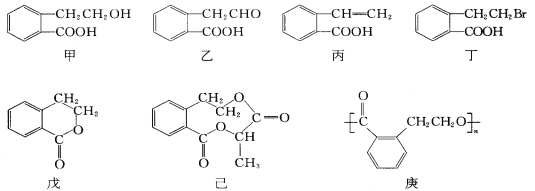
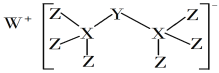题目内容
【题目】K2Cr2O7是重要氧化剂。工业制备重铬酸钾的原理是:将铬铁矿与纯碱按一定比例混合在高温下煅烧:①4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+8CO2;②2Na2CrO4+H2SO4=Na2Cr2O7+H2O+Na2SO4;③Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl。下列有关说法正确的是
2Fe2O3+8Na2CrO4+8CO2;②2Na2CrO4+H2SO4=Na2Cr2O7+H2O+Na2SO4;③Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl。下列有关说法正确的是
A.反应①中Na2CO3作还原剂
B.反应①中每生成80gFe2O3转移7mol电子
C.反应②中,可以用浓盐酸替代硫酸
D.反应③符合溶解度较小物质转化成溶解度较大的物质
【答案】B
【解析】
此题主要是氧化还原反应的分析及计算。
A. 反应①中Fe(CrO2)2是还原剂,氧气作氧化剂,碳酸钠中各元素化合价均没有变化,故A错误。
B. 生成2 mol(相当于320 g)Fe2O3时转移28mol电子,故B正确。
C. Na2Cr2O7具有强氧化性,浓盐酸具有还原性,二者发生氧化还原反应,故C错误。
D. 反应③中重铬酸钾的溶解度小于重铬酸钠,故D错误。
故答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目