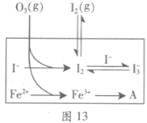
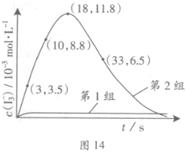
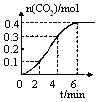
��Ŀ����
��16�֣���һ�ݻ�Ϊ2 L���ܱ������ڼ���0.2 molA��0.6 molB����һ�������·�����Ӧ��A(s)��3B(g) 2C(s)��3D(g) ��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����±���
2C(s)��3D(g) ��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����±���
��ش��������⣺
�Ÿ÷�Ӧ��ƽ�ⳣ������ʽK�� ����H 0(���������)��
��1000 ��ʱ,4 min��ﵽƽ�⣮��4 min��D��ƽ����Ӧ����v(D)�� ��B��ƽ��ת����Ϊ ��ƽ��ʱB��������� ��
������ߢ���B��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��
A������C���� B������A���� C���Ƴ�����D
D�����ͷ�Ӧ�¶� E����С�������ݻ� F��������ʵĴ���
��1000 ��ʱ, ��һ�ݻ�Ϊ2 L���ܱ������ڼ���XmolC��0.6 molD��5 min��ﵽƽ�⣬B��Ũ�������B��Ũ����ͬ����X�ķ�Χ
������˵������˵����Ӧ�Ѵﵽƽ��״̬����
A�������ڻ�������ѹǿ����ʱ��仯���� B��B�����ʲ���ʱ��ı仯���仯
C��c(B)�Uc(D)=1�U1 D�����������ܶȱ��ֲ���(M(B)��M(D))
 2C(s)��3D(g) ��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����±���
2C(s)��3D(g) ��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����±���| �¶�/�� | 1000 | 1150 | 1300 |
| ƽ�ⳣ�� | 64��0 | 50.7 | 42��9 |
�Ÿ÷�Ӧ��ƽ�ⳣ������ʽK�� ����H 0(���������)��
��1000 ��ʱ,4 min��ﵽƽ�⣮��4 min��D��ƽ����Ӧ����v(D)�� ��B��ƽ��ת����Ϊ ��ƽ��ʱB��������� ��
������ߢ���B��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��
A������C���� B������A���� C���Ƴ�����D
D�����ͷ�Ӧ�¶� E����С�������ݻ� F��������ʵĴ���
��1000 ��ʱ, ��һ�ݻ�Ϊ2 L���ܱ������ڼ���XmolC��0.6 molD��5 min��ﵽƽ�⣬B��Ũ�������B��Ũ����ͬ����X�ķ�Χ
������˵������˵����Ӧ�Ѵﵽƽ��״̬����
A�������ڻ�������ѹǿ����ʱ��仯���� B��B�����ʲ���ʱ��ı仯���仯
C��c(B)�Uc(D)=1�U1 D�����������ܶȱ��ֲ���(M(B)��M(D))
��c3(D) / c3(B) ���� ���� 0.06 mol��L��1��min��1��80�� ��20�� �� CD ���� ��0.08 ���� BD ��
������������ݻ�ѧƽ�ⳣ���Ķ���ɵ�K= c3(D) / c3(B)�����������¶ȣ�ƽ�ⳣ����С��˵�������¶ȣ���ѧƽ�����淴Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ�����Ը÷�Ӧ������ӦΪ���ȷ�Ӧ����˦�H��0. ��1000 ��ʱ,4 min��ﵽƽ�⣮����ﵽƽ��ʱ����D�����ʵ���Ũ��Ϊx,������B�����ʵ���Ũ��Ҳ��x��ƽ��ʱB��Ũ��Ϊ(0.3-x)mol/L��x3/(0.3-x)3=64��0�����x=0.24mol/L����4 min��D��ƽ����Ӧ����v(D)��0.24mol/L��4min=0.06mol/(L��min)��B��ת����Ϊ(0.24mol/L��0.3mol/L)��100��=80���� ��Ϊ�ڷ�Ӧ�ﵽƽ��ʱB�����ʵ���Ũ��Ϊ(0.3-x)mol/L=��0.3-0.24��mol/L=0.06mol/L�÷�Ӧ�Ǹ���Ӧǰ�����������ȵķ�Ӧ��Ԫ��ƽ��ʱB�����������0.06mol/L��0.3mol/L)��100��=20���� ��A������C�ǹ��壬���Լ���C�������Ի�ѧƽ����ƶ���Ӱ�졣����B������A��״̬�ǹ��壬��������A������ƽ�ⲻ�ƶ�������C���Ƴ�����D���ӳ��������Ũ�ȣ�ƽ�������ƶ���B��ƽ��ת������ߡ���ȷ��D�����ͷ�Ӧ�¶ȣ�ƽ�������ƶ���B��ƽ��ת������ߡ���ȷ��E����С�������ݻ�����Ϊ�÷�Ӧ�Ƿ�Ӧǰ�����������ȵķ�Ӧ�����Ըı�ѹǿ����ѧƽ�ⲻ�ƶ�������F��������ʵĴ���������Ӧ���淴Ӧ�����ʼӿ죬����ƽ�ⲻ�����ƶ������������ȷѡ��ΪCD����4���ڷ�Ӧ��ʼʱc(D)=0.3mol/L������Ӧ�ﵽƽ���c(B)= 0.06mol/L����Ϊ�ڷ���ʽ��B��D��ϵ����ͬ�����D��ƽ��Ũ��Ϊc(D)(ƽ��)=0.24mol/L�������ڻ�ѧ����ʽA(s)��3B(g)
 2C(s)��3D(g)��C��B=2:3���������ĵ�C�����ʵ���Ϊ0.06mol/L��2L��2/3=0.08mol���÷�ӦΪ���淴Ӧ�����ﵽƽ���Ӧ�ô���C���ʡ���˿�ʼʱ�����C�����ʵ���Ӧ�ñ�0.08mol�ࡣ��X��0.08mol����A�����ڸ÷�Ӧ�Ƿ�Ӧǰ�����������ȵĿ��淴Ӧ�����۷�Ӧ�Ƿ�ﵽƽ�⣬�����ڻ�������ѹǿ������ʱ��仯���䡣����B����ΪB����̬���ʡ����������ʲ���ʱ��ı仯���仯��˵����Ũ�Ȳ��ٷ����仯����Ӧ�ﵽƽ�⡣��ȷ��C�������ڷ���ʽ�ж��ߵ�ϵ����ͬ�������κ�ʱ��c(B)�Uc(D)=1�U1������˵����Ӧ�ﵽƽ��״̬������D����Ϊ�μӷ�Ӧ�������й��壬����M(B)��M(D)������Ӧ�ﵽƽ��״̬������������������䣬���������䣬���������ܶȱ��ֲ��䣻����Ӧδ�ﵽƽ�⣬���������������Ҫ�����仯������������ܶȾ�Ҫ�����仯����˸�����������Ϊ��Ӧ�ﵽƽ��ı�־����ȷ��
2C(s)��3D(g)��C��B=2:3���������ĵ�C�����ʵ���Ϊ0.06mol/L��2L��2/3=0.08mol���÷�ӦΪ���淴Ӧ�����ﵽƽ���Ӧ�ô���C���ʡ���˿�ʼʱ�����C�����ʵ���Ӧ�ñ�0.08mol�ࡣ��X��0.08mol����A�����ڸ÷�Ӧ�Ƿ�Ӧǰ�����������ȵĿ��淴Ӧ�����۷�Ӧ�Ƿ�ﵽƽ�⣬�����ڻ�������ѹǿ������ʱ��仯���䡣����B����ΪB����̬���ʡ����������ʲ���ʱ��ı仯���仯��˵����Ũ�Ȳ��ٷ����仯����Ӧ�ﵽƽ�⡣��ȷ��C�������ڷ���ʽ�ж��ߵ�ϵ����ͬ�������κ�ʱ��c(B)�Uc(D)=1�U1������˵����Ӧ�ﵽƽ��״̬������D����Ϊ�μӷ�Ӧ�������й��壬����M(B)��M(D)������Ӧ�ﵽƽ��״̬������������������䣬���������䣬���������ܶȱ��ֲ��䣻����Ӧδ�ﵽƽ�⣬���������������Ҫ�����仯������������ܶȾ�Ҫ�����仯����˸�����������Ϊ��Ӧ�ﵽƽ��ı�־����ȷ��
��ϰ��ϵ�д�
 ��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
�����Ŀ
 NaNO3��s��+ClNO��g�� K1 ?H < 0 ��I��
NaNO3��s��+ClNO��g�� K1 ?H < 0 ��I�� 4NO(g)��6HO(g) ��H����Q kJ�� mol��1(Q��0)�������ڲ������ʵ����ʵ���Ũ�����±���
4NO(g)��6HO(g) ��H����Q kJ�� mol��1(Q��0)�������ڲ������ʵ����ʵ���Ũ�����±��� Z �ڷ�Ӧ�����еķ�Ӧ���ʣ�v����ʱ�䣨t���Ĺ�ϵ���ߣ�������������ȷ���� �� ��
Z �ڷ�Ӧ�����еķ�Ӧ���ʣ�v����ʱ�䣨t���Ĺ�ϵ���ߣ�������������ȷ���� �� �� 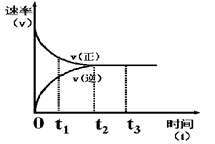
 2Z2�ڷ�Ӧ�����еķ�Ӧ���ʣ�v����ʱ�䣨t���Ĺ�ϵ���ߣ�����������ȷ����( )��
2Z2�ڷ�Ӧ�����еķ�Ӧ���ʣ�v����ʱ�䣨t���Ĺ�ϵ���ߣ�����������ȷ����( )��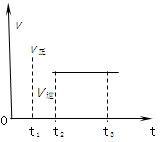
 x Q(g)+3R(g)����2min��ƽ�⣬����2.4molR�������Q��Ũ��Ϊ0.4mol/L����
x Q(g)+3R(g)����2min��ƽ�⣬����2.4molR�������Q��Ũ��Ϊ0.4mol/L����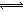 HOI(aq) ��H2
HOI(aq) ��H2