题目内容
1.下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: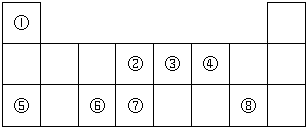
(1)⑦在周期表中的位置第三周期第ⅣA族,④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O.
(2)②、③、⑦的最高价氧化物对应水化物的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3.
(3)⑥的氧化物与氢氧化钠溶液反应的离子方程式:Al2O3+2OH-═2AlO2-+H2O.
(4)③的氢化物的电子式为:
 ,该氢化物中含有的化学键是极性共价键.
,该氢化物中含有的化学键是极性共价键.
分析 由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)电子层越多半径越大,电子层一样多的原子,核电荷数越多半径越小;
(2)同一周期元素的原子,从左到右最高价氧化物对应水化物的酸性逐渐增强;同主族从上到下最高价氧化物对应水化物的酸性逐渐减弱;
(3)⑥的氧化物为氧化铝,与氢氧化钠溶液反应生成偏铝酸钠和水;
(4)③的氢化物为氨气,只含N-H键.
解答 解:由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)⑦为Si,位于第三周期第ⅣA族,在周期表中电子层越多半径越大,所以Na、Al>O,电子层一样多的原子,核电荷数越多半径越小,即Na>Al,即原子半径为Na>Al>O,故答案为:第三周期第ⅣA族;Na>Al>O;
(2)②③是C、N,是同一周期元素的原子,由同周期从左到右最高价氧化物对应水化物的酸性逐渐增强,所以酸性:HNO3>H2CO3,②⑦是C、Si,是同主族元素,根据元素周期律:从上到下最高价氧化物对应水化物的酸性逐渐减弱,酸性为H2CO3>H2SiO3,则酸性为HNO3>H2CO3>H2SiO3,
故答案为:HNO3>H2CO3>H2SiO3;
(3)⑥的氧化物为氧化铝,与氢氧化钠溶液反应生成偏铝酸钠和水,离子反应为Al2O3+2OH-═2AlO2-+H2O,故答案为:Al2O3+2OH-═2AlO2-+H2O;
(4)③的氢化物为氨气,其电子式为, ,只含N-H极性共价键,故答案为:
,只含N-H极性共价键,故答案为: ;极性共价键.
;极性共价键.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素化合物的性质、元素周期律为解答的关键,侧重分析、推断及应用能力的考查,题目难度不大.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
11.物质中杂质(括号内为杂质)的检验、除杂的试剂或方法都正确的是( )
| 物质及其杂质 | 检验 | 除杂 | |
| A | Cl2(HCl) | 湿润的淀粉KI试纸 | 饱和食盐水 |
| B | NO(NO2) | 观察颜色或湿润的淀粉KI试纸 | 水 |
| C | CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和NaHCO3溶液 |
| D | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 | 过量CO2 |
| A. | A | B. | B | C. | C | D. | D |
12.化学与人们的日常生活密切相关,下列叙述正确的是( )
| A. | 二氧化硅是制造玻璃、光导纤维的原料 | |
| B. | 纤维素、油脂是天然有机高分子化合物 | |
| C. | 白菜上洒少许福尔马林,既保鲜又消毒 | |
| D. | NOx、CO2、PM2.5颗粒都会导致酸雨 |
9.下列说法正确的是( )
| A. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 | |
| B. | 石英玻璃、陶瓷都属于硅酸盐产品 | |
| C. | 做衣服的棉、麻、蚕丝的成分都是纤维素 | |
| D. | 牛油和花生油在碱性条件下水解产物相同 |
16.化学与生活、社会密切相关,下列有关说法中正确的是( )
| A. | “低碳生活”是指生活中尽量使用含碳量较低的物质 | |
| B. | 燃煤中加入CaO后可减少酸雨的发生及温室气体的排放 | |
| C. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 | |
| D. | 鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排 |
13.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 0.1 mol•L-1Ba(OH)2溶液中含有0.2nA个OH- | |
| B. | 1mol Na与足量水反应,转移2nA个电子 | |
| C. | 常温常压下,22.4L乙烯含有nA个CH2=CH2分子 | |
| D. | 常温常压下,46g NO2含有2nA个氧原子 |
10.下列物质的制备线索中,不符合工业生产实际的是( )
| A. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{O_{2}•H_{2}O}{→}$HNO3 | |
| B. | 浓缩海水$\stackrel{CI_{2}}{→}$Br2$\stackrel{鼓入热空气}{→}$Br2(粗产品)$\stackrel{精制}{→}$Br2 | |
| C. | MnO2$→_{加热}^{浓HCI}$Cl2$\stackrel{Ca(OH)_{2}}{→}$漂白粉 | |
| D. | 石油$\stackrel{裂解}{→}$乙烯$→_{加热}^{催化剂}$聚乙烯 |
15.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)→2HCl(g)+Q1
H2(g)+Br2(g)→2HBr(g)+Q2 根据上述反应做出的判断正确的是( )
H2(g)+Cl2(g)→2HCl(g)+Q1
H2(g)+Br2(g)→2HBr(g)+Q2 根据上述反应做出的判断正确的是( )
| A. | Q1>Q2 | |
| B. | 生成物总能量均高于反应物总能量 | |
| C. | 生成1mol HCl(g)放出Q1热量 | |
| D. | 等物质的量时,Br2(g)具有的能量低于Br2(l) |