题目内容
7.下列说法不正确的是( )| A. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2 c (Na+)=c(CH3COO-)+c(CH3COOH) | |
| B. | 将0.4mol/LNH4Cl溶液和0.2mol/LNaOH溶液等体积混合后,溶液中粒子的物质的量浓度大小关系为:c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | 将纯水加热至较高温度,水的离子积变大,pH变大,呈中性 | |
| D. | 将稀氨水加水稀释,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}.{H}_{2}O)}$ 增大 |
分析 A.根据等浓度的醋酸和醋酸钠溶液中的物料守恒分析;
B.反应后溶质为等浓度的氯化铵、氯化钠和一水合氨,一水合氨的电离程度大于铵根离子的水解,溶液显示碱性;
C.水的电离为吸热反应,升高温度后水的电离程度增大,水中氢离子浓度增大,溶液的pH减小;
D.根据氨水的电离平衡常数可知,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}.{H}_{2}O)}$=$\frac{{K}_{b}}{c(O{H}^{-})}$,稀释过程中氢氧根离子浓度减小,电离平衡常数不变.
解答 解:A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后,根据混合液中的物料守恒可得:2c(Na+)=c(CH3COOH)+c(CH3COO-),故A正确;
B.将0.4mol/LNH4Cl溶液和0.2mol/LNaOH溶液等体积混合后,溶质为等浓度的NaCl、NH4Cl和NH3•H2O,由于一水合氨的电离程度大于铵根离子的水解程度,则混合液显示碱性,溶液中粒子的物质的量浓度大小关系为:c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+),故B正确;
C.将纯水加热至较高温度,水的离子积变大,溶液中氢离子、氢氧根离子浓度增大,溶液仍然为中性,但是溶液的pH变小,故C错误;
D.该氨水溶液中,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}.{H}_{2}O)}$=$\frac{{K}_{b}}{c(O{H}^{-})}$,由于稀释后溶液的温度不变,则氨水的电离平衡常数Kb不变,而氢氧根离子浓度减小,所以该比值增大,故D正确;
故选C.
点评 本题考查了离子浓度大小比较、水的电离、弱电解质的电离及其影响,题目难度中等,试题知识点较多,充分考查了学生的分析、理解能力,注意掌握电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用方法.

| A. | 431 kJ/mol | B. | 946 kJ/mol | C. | 649 kJ/mol | D. | 869 kJ/mol |
 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | -- | 338.0 | 1.84 |
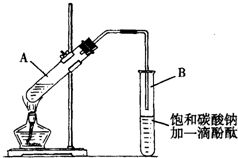
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液.
②按如图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min.
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层、洗涤、干燥.
请根据题目要求回答下列问题:
(1)写出制取乙酸乙酯的化学方程式:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):BC
A、中和乙酸和乙醇
B、中和乙酸并吸收部分乙醇
C、乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D、加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是:减少乙酸乙醇的挥发,减少副反应的发生.
(4)指出步骤③所观察到的现象:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅.
| A. | 能发生银镜反应的物质不一定是醛 | |
| B. | 酯在碱性条件下的水解生成相应的羧酸和醇 | |
| C. | 参与酯化反应的物质一定有两种 | |
| D. | 苯酚中羟基对苯环的影响是使苯环上氢原子都变的很活泼 |
| A. | CH3CH2CH2CH3和CH3CH=CHCH3 | B. | CH3CH=CHCH3和 CH3C≡CCH3 | ||
| C. | CH3CH=CHCH3和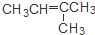 | D. | CH3CH2CH2OH和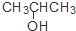 |
| A. | SO2可用来漂白馒头、银耳等食品 | |
| B. | 纯净的二氧化硅是制备光导纤维的原料 | |
| C. | 氢氧化铝可以用做耐火材料 | |
| D. | 四氧化三铁常用作红色油漆和涂料 |
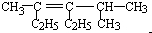 2,4-二甲基-3-乙基-3-己烯
2,4-二甲基-3-乙基-3-己烯  3-甲基-2-乙基-1-丁烯
3-甲基-2-乙基-1-丁烯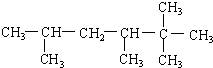 2,2,3,5-四甲基己烷.
2,2,3,5-四甲基己烷.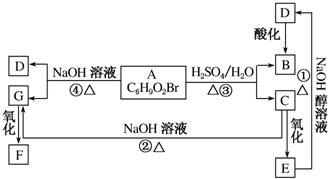 有机物A、B、C、D、E、F、G相互关系如图所示.已知F分子中含有两个相同的官能团,5.2gF能与100mL1mol•L-1的NaOH溶液恰好完全中和.D的分子式为C3H3O2Na,E的分子中含有羧基.
有机物A、B、C、D、E、F、G相互关系如图所示.已知F分子中含有两个相同的官能团,5.2gF能与100mL1mol•L-1的NaOH溶液恰好完全中和.D的分子式为C3H3O2Na,E的分子中含有羧基.