题目内容
10.A、B、C、D四种非金属元素,A、B在反应中各结合1个电子形成稳定结构,放出能量B<A;氢化物稳定性HD>HA;原子序数C<B,其稳定结构的核外电子数相等.则四种元素非金属性由强到弱的顺序正确的是( )| A. | A、B、C、D | B. | B、A、C、D | C. | D、A、B、C | D. | B、A、D、C |
分析 A、B在反应中各结合1个电子形成稳定结构,放出能量B<A,说明A得电子能力大于B,则非金属性A>B;
氢化物的稳定性越强,则非金属性越强,得电子能力越强,所以非金属性D>A;
原子序数C<B,其稳定结构的核外电子数相等,非金属性越强的元素其原子序数越大,所以非金属性B>C,据此分析解答.
解答 解:A、B在反应中各结合1个电子形成稳定结构,放出能量B<A,说明A得电子能力大于B,则非金属性A>B;
氢化物的稳定性越强,则非金属性越强,得电子能力越强,所以非金属性D>A;
原子序数C<B,其稳定结构的核外电子数相等,非金属性越强的元素其原子序数越大,所以非金属性B>C,
通过以上分析知,非金属性强弱顺序是D、A、B、C,故选C.
点评 本题考查非金属性强弱判断,为高考高频点,明确同一周期非金属性强弱顺序、非金属元素非金属性强弱与其氢化物的关系等知识点即可解答,题目难度不大.

练习册系列答案
相关题目
20.下列相关实验的操作或结论正确的是( )
| A. | 将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 | |
| B. | 制硝基苯时温度计水银球在反应液中 | |
| C. | 实验室制乙烯时温度计水银球在反应液中 | |
| D. | 检验溴乙烷中的溴元素时,将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,滴加AgNO3溶液 |
18.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 15g甲基所含有的电子数是10NA个 | |
| B. | 1mol苯乙烯中含有的碳、碳双键数为4NA个 | |
| C. | 标准状况下,1L庚烷所含有的分子数为NA/22.4 | |
| D. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 |
15.酚酞是中学阶段常用的酸碱指示剂,结构简式如图所示:下列关于酚酞的说法错误的是( )
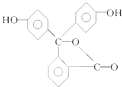

| A. | 酚酞与水可以形成氢键 | |
| B. | 酚酞的分子式为C20H14O4 | |
| C. | 酚酞结构中含有羟基(-OH),故酚酞属于醇 | |
| D. | 酚酞在一定条件下能够发生加成反应 |
2.NA代表阿伏伽德罗常数.已知C2H4和C3H6的混合物的质量为ag,则该混合物( )
| A. | 所含共用电子对数目为$\frac{a}{7+1}$NA | B. | 所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | ||
| C. | 燃烧时消耗的O2一定是$\frac{33.6a}{14}$ L | D. | 所含原子总数为$\frac{a{N}_{A}}{14}$ |
20.关于[Cr(H2O)4Br2]Br•2H2O的说法正确的是( )
| A. | 配体为水分子,配原子为O,外界为Br- | |
| B. | 中心离子的配位数为6 | |
| C. | 中心离子Cr3+采取sp3杂化 | |
| D. | 中心离子的化合价为+2 |
 .
.