题目内容
20.关于[Cr(H2O)4Br2]Br•2H2O的说法正确的是( )| A. | 配体为水分子,配原子为O,外界为Br- | |
| B. | 中心离子的配位数为6 | |
| C. | 中心离子Cr3+采取sp3杂化 | |
| D. | 中心离子的化合价为+2 |
分析 A.[Cr(H2O)4Br2]Br•2H2O中配体是H2O、Br;
B.[Cr(H2O)4Br2]-中的中心离子的配体是H2O、Br,根据水分子个数和溴原子个数确定配位数个数;
C.铬离子采用d2sp3杂化;
D.根据配合物中各元素化合价的代数和为0确定中心离子的化合价.
解答 解:A.[Cr(H2O)4Br2]Br•2H2O中配位体是H2O、配原子为Br,外界为Br-,故A错误;
B.[Cr(H2O)4Br2]-中的中心离子的配体是H2O、Br,该配离子中含有4个H2O、2个Br,所以配位数是6,故B正确;
C.中心原子铬离子配位数是6,含有6个σ键,所以铬离子采用d2sp3杂化,故C错误;
D.[Cr(H2O)4Br2]Br•2H2O中阴离子是溴离子,溴离子的化合价是-1价,所以铬离子的化合价是+3价,故D错误;
故选B.
点评 本题考查了配合物的配位体的判断、配位数的计算方法、成键情况、化合物中元素的化合价代数和为0等知识,注意配位数个数的计算方法、中心原子的杂化方式等,为易错点,题目难度中等.

练习册系列答案
相关题目
10.A、B、C、D四种非金属元素,A、B在反应中各结合1个电子形成稳定结构,放出能量B<A;氢化物稳定性HD>HA;原子序数C<B,其稳定结构的核外电子数相等.则四种元素非金属性由强到弱的顺序正确的是( )
| A. | A、B、C、D | B. | B、A、C、D | C. | D、A、B、C | D. | B、A、D、C |
8.下列解释过程或事实的方程式不正确的是( )
| A. | 熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH=Na2SiO3+H2O | |
| B. | 甲醇燃料电池(KOH作电解质溶液)的负极反应式:CH3OH-6e+H2O=CO2+6H+ | |
| C. | 红热的铁丝与水接触,表面形成黑色保护层:3Fe+4H2O=Fe3O4+4H2 | |
| D. | “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO-+Cl-+2H+=Cl2↑+H2O |
15.下列粒子中,其最外层与最里层的电子数之和等于次外层电子数的是( )
| A. | S | B. | Mg | C. | Cl | D. | Be |
5.说法正确的是( )
| A. | 含有非极性键的分子一定是非极性分子 | |
| B. | 非极性分子中一定含有非极性键 | |
| C. | 由极性键形成的双原子分子一定是极性分子 | |
| D. | 键的极性与分子的极性无关 |
9.食品和药品关系人的生存和健康.市场上销售的食盐品种很多.下列食盐中,所添加的元素不属于人体必需微量元素的是( )
| A. | 加锌盐 | B. | 加碘盐 | C. | 加钙盐 |
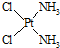 )中的Pt的化合价为+2.
)中的Pt的化合价为+2.
 .
. +
+ $\stackrel{H+}{?}$
$\stackrel{H+}{?}$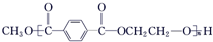 +(2n-1)CH3OH;G的同分异构体有多种,则满足下列条件的共有12种.
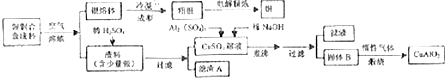
+(2n-1)CH3OH;G的同分异构体有多种,则满足下列条件的共有12种. 合成
合成 的流程图(写出反应物和反应条件).注:书写格式参照如下示例流程图:
的流程图(写出反应物和反应条件).注:书写格式参照如下示例流程图: