题目内容
15.氯气常用于自来水厂杀菌消毒.(1)工业上用铁电极和石墨做为电极电解饱和食盐水生产氯气,石墨电极上的电极反应式为2Cl--2e-═Cl2↑
氯氧化法是在一定条件下,用Cl2将废水中的CN-氧化成无毒的N2和CO2.该反应的离子方程式为5Cl2+2CN-+8OH-═10Cl-+N2↑+2CO2↑+4H2O
(2)氯胺(NH2Cl)消毒法是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2+NH3═NH2Cl+HCl,生成的NH2Cl比HClO稳定,且能部分水解重新生成HClO,起到消毒杀菌的作用.氯胺能消毒杀菌的原因是NH2Cl+H2O?NH3+HClO(用化学方程式表示).
(3)在水产养殖中,可以用Na2S2O3将水中残余的微量Cl2除去,某实验小组利用如图1所示装置和药品制备Na2S2O3.
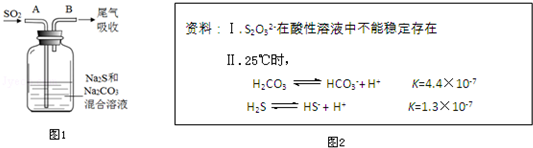
结合上述资料回答:
①开始通SO2时,在B口检测到有新的气体生成,判断从B口排出的气体中是否含有H2S,并写出判断依据由电离常数知H2CO3酸性强于H2S,溶液中的S2-与H2CO3反应生成H2S.
②为获得较多的Na2S2O3,当溶液的pH接近7时,应立即停止通入SO2,其原因 是S2O32-在酸性溶液中不能稳定存在.
分析 (1)金属为阳极时失去电子,则铁为阴极,所以石墨为阳极,阳极上氯离子放电生成氯气;Cl2将废水中的CN-氧化成无毒的N2和CO2,以此书写离子反应;
(2)NH2Cl能部分水解生成HClO和氨气;
(3)①发生强酸制取弱酸的反应生成H2S;
②当溶液的pH接近7时,应立即停止通入SO2,因在酸性溶液中S2O32-发生氧化还原反应.
解答 解:(1)用惰性电极电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电,电解反应为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,铁应为阴极,石墨为阳极,则阳极反应为2Cl--2e-═Cl2↑;Cl2将废水中的CN-氧化成无毒的N2和CO2,离子方程式为5Cl2+2CN-+8OH-═10Cl-+N2↑+2CO2↑+4H2O,
故答案为:2Cl--2e-═Cl2↑;5Cl2+2CN-+8OH-═10Cl-+N2↑+2CO2↑+4H2O;
(2)NH2Cl能部分水解生成HClO和氨气,可起消毒杀菌的作用,方程式为NH2Cl+H2O?NH3+HClO,故答案为:NH2Cl+H2O?NH3+HClO;
(3)①开始通SO2时,在B口检测到有新的气体生成,发生强酸制取弱酸的反应,则判断含H2S的依据为由电离常数知H2CO3酸性强于H2S,溶液中的S2-与H2CO3反应生成H2S,
故答案为:由电离常数知H2CO3酸性强于H2S,溶液中的S2-与H2CO3反应生成H2S;
②为获得较多的Na2S2O3,当溶液的pH接近7时,应立即停止通入SO2,其原因是S2O32-在酸性溶液中不能稳定存在,故答案为:S2O32-在酸性溶液中不能稳定存在.
点评 本题考查氯气的性质及电化学反应原理的应用,为高频考点,把握物质的性质、发生的反应、化学反应原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.

| A. | 相同浓度时,溶液的导电能力的强弱 | |
| B. | 在水溶液里电解质是否全部电离为离子 | |
| C. | 是离子化合物还是共价化合物 | |
| D. | 强电解质易溶于水,弱电解质难溶于水 |
| A. | V(碱)=10V(酸) | B. | V(酸)=10V(碱) | C. | V(酸)=2V(碱) | D. | V(酸)=V(碱) |
| A. | 缩小容器的容积 | B. | 使用催化剂 | C. | 恒压下充入He | D. | 恒容下充入Cl2 |


 .
.