题目内容
5.恒温下2HI(g)?H2(g)+I2(g)分解达到平衡,改变下列条件能引起平衡移动的是( )| A. | 缩小容器的容积 | B. | 使用催化剂 | C. | 恒压下充入He | D. | 恒容下充入Cl2 |
分析 反应2HI(g)?H2(g)+I2(g)是前后气体系数和不变化的反应,所以压强不会引起平衡的移动,根据化学平衡移动原理来回答.
解答 解:A、缩小容器的容积相当于增大压强,反应2HI(g)?H2(g)+I2(g)是前后气体系数和不变化的反应,压强变化不会引起平衡移动,故A错误;
B、使用催化剂不会引起化学平衡的移动,故B错误;
C、恒压下充入He,体积增大,各组分的浓度减小,相当于各组分的压强减小,压强变化不会引起平衡移动,所以平衡不移动,故C错误;
D、恒容下充入Cl2,会消耗碘化氢,平衡逆向移动,故D正确.
故选D.
点评 本题考查学生化学平衡移动原理的应用知识,注意知识的归纳和梳理是解题的关键,难度中等.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
16.查阅元素周期表,从每个方格中不能得到的信息是( )
| A. | 相对原子质量 | B. | 元素名称 | C. | 原子序数 | D. | 同位素种类 |
10.下列等物质的量的各组物质,分别投入足量的等质量稀硫酸溶液中,不考虑水的挥发,反应后溶液质量相等.符合条件的有( )
①Na,Mg ②Na2O,Na2O2 ③KHCO3,CaCO3 ④Na,Na2O2 ⑤Na2O,Na2CO3 ⑥Na2CO3,NaHCO3.
①Na,Mg ②Na2O,Na2O2 ③KHCO3,CaCO3 ④Na,Na2O2 ⑤Na2O,Na2CO3 ⑥Na2CO3,NaHCO3.
| A. | ⑤ | B. | ①②⑤ | C. | ④⑥ | D. | ②④⑥ |
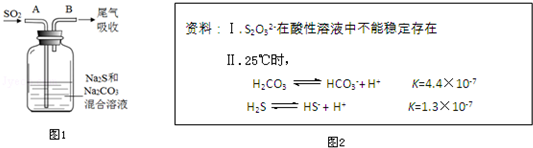
17.下列实验装置不能达到实验目的是( )
| A. | 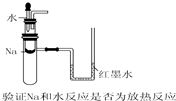 | B. |  | ||
| C. |  | D. | 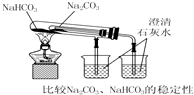 |
14.下列离子的检验方法正确的是( )
| A. | 向待测液中先加入硝酸钡溶液有白色沉淀,再加入稀盐酸,白色沉淀不消失,可以确认待测液中含有SO42- | |
| B. | 向待测液中加入NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,可以确认待测液中含有NH4+ | |
| C. | 向待测液中先加入氯水,再滴入KSCN溶液,溶液变红,可以确认待测液中含有Fe2+ | |
| D. | 用玻璃棒蘸取待测液并在酒精灯火焰上灼烧,火焰呈黄色,可以确认待测液中含有Na+ |
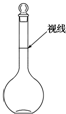 实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有: