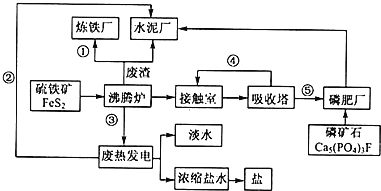
题目内容
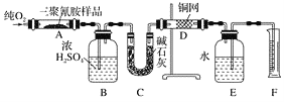
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按如图路线合成:
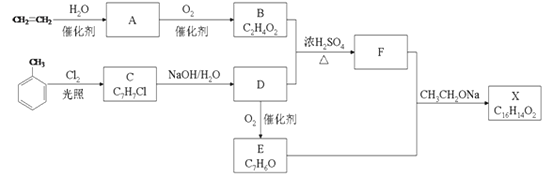
(1)写出由乙烯制取A的化学方程式:____。
(2)乙烯能使溴水和酸性KMnO4溶液褪色,二者褪色原理相同吗?_____。原因是______。
(3)以乙烯为原料,能否制得乙炔?_____。若能,请写出相关的化学方程式_______。
(4)请写出C的含有苯环的同分异构体的结构简式:______。
(5)写出甲苯与浓硝酸和浓硫酸的混合酸反应的化学方程式:_____。
(6)写出C→D的化学方程式:_______,
(7)C能发生消去反应吗?______。原因是_______。
【答案】CH2=CH2+H2O![]() CH3CH2OH 不同 乙烯使溴水褪色是发生了加成反应,而使酸性高锰酸钾褪色是发生了氧化反应 能 CH2=CH2+Br2→
CH3CH2OH 不同 乙烯使溴水褪色是发生了加成反应,而使酸性高锰酸钾褪色是发生了氧化反应 能 CH2=CH2+Br2→![]() 、
、![]() +2NaOH
+2NaOH![]() CH≡CH↑+2NaBr+2H2O
CH≡CH↑+2NaBr+2H2O ![]() 、
、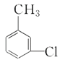 、
、![]()
![]() +3HNO3
+3HNO3![]()
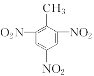 +3H2O
+3H2O ![]() +NaOH
+NaOH![]() +NaCl 不能
+NaCl 不能 ![]() 中氯原子相连的碳原子的邻位碳原子上没有氢原子
中氯原子相连的碳原子的邻位碳原子上没有氢原子
【解析】
乙烯和水加成得到乙醇(A),乙醇氧化生成乙酸(B)。甲苯在光照下和氯气发生取代反应得到C(![]() ),
),![]() 在NaOH水溶液作用下发生水解反应得到苯甲醇(D),苯甲醇和乙酸发生酯化反应生成苯甲酸乙酯(F)。
在NaOH水溶液作用下发生水解反应得到苯甲醇(D),苯甲醇和乙酸发生酯化反应生成苯甲酸乙酯(F)。
(1)乙烯和水加成制取乙醇的化学方程式为:CH2=CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
(2)乙烯使溴水褪色是乙烯和溴水中的溴发生了加成反应,乙烯使酸性KMnO4溶液褪色是乙烯还原了酸性KMnO4,把MnO4-还原成了Mn2+,从而酸性KMnO4褪色;
(3)乙烯先和溴加成得到1,2-二溴乙烷,然后1,2-二溴乙烷再发生消去反应即可得到乙炔,方程式为:CH2=CH2+Br2→![]() ,
,![]() +2NaOH
+2NaOH![]() CH≡CH↑+2NaBr+2H2O。
CH≡CH↑+2NaBr+2H2O。
(4)把C(![]() )中的氯原子和碳原子(即甲基)分别连在苯环的两个碳原子上,即可得C的含有苯环的同分异构体,结构简式为
)中的氯原子和碳原子(即甲基)分别连在苯环的两个碳原子上,即可得C的含有苯环的同分异构体,结构简式为![]() 、
、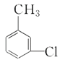 、
、![]() ;
;
(5)甲苯与浓硝酸和浓硫酸的混合酸发生取代反应生成2,4,6-三硝基甲苯(即TNT)的化学方程式为:![]() +3HNO3
+3HNO3![]()
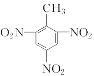 +3H2O;
+3H2O;
(6)C→D发生了卤代烃的水解反应,化学方程式为:![]() +NaOH
+NaOH![]() +NaCl;
+NaCl;
(7)C不能发生消去反应。因为卤代烃的消去反应除了要断裂C-X键外,还要断裂和卤素原子相连的碳原子的邻位碳原子上的C-H键,而C中和氯原子相连的碳原子的邻位碳原子上没有氢原子,所以不能发生消去反应。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案【题目】如图为碳元素的价类二维图,结合图中的物质部分转化关系,完成下列问题:
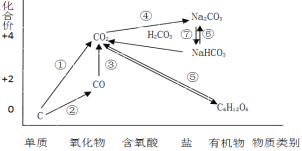
(1)下列说法正确的是 __________
a.要实现反应①一定要与氧化剂作用
b.要实现反应②一定要与还原剂作用
c.在一定条件下木炭与浓硝酸能实现 反应①转化
d.反应⑤属于非氧化还原反应
(2)下列有关碳及其化合物类别及性质说法不正确的是__________
a.CO不属于酸性氧化物,具有还原性
b.CO2属于酸性氧化物,可以与碱反应生成碳酸盐
c.NaHCO3属于弱酸的酸式盐,既能与硫酸反应又能与NaOH反应
d.金刚石和石墨互为同素异形体,其物理性质和化学性质均相同
(3)高炉炼铁的过程是将铁矿石(Fe2O3)还原成金属铁的过程,实现了反应③的转化,请写出其反应的化学方程式,并用“双线桥”表示电子的得失情况______________________________ 。
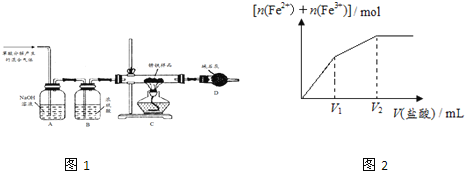
(4)化学活动课上,两组同学分别用如图所示甲、乙两装置探究“Na2CO3、NaHCO3与稀盐酸的反应”。按下表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。请回答:
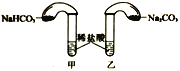
①两组反应开始时,装置___________(填“甲”或“乙”)中的气球体积先变大,该装置中反应的离子方程式是______________________。
②当试管中不再有气体生成时,两组实验出现不同现象。
试剂用量 | 实验现象 | 分析原因 | |
第A组 | 0.84gNaHCO3 1.06gNa2CO3 6ml 4mol·L-1盐酸 | 甲中气球与乙中气球的 体积相等 | 甲、乙盐酸均过量 n(NaHCO3)= n(Na2CO3) V(CO2)甲=V(CO2)乙 |
第B组 | 1.2gNaHCO3 1.2gNa2CO3 6ml 2mol·L-1盐酸 | 甲中气球比乙中气球的体积大 片刻后,乙中气球又缩小,甲中气球的体积基本不变 |
|
按上表第A组原因分析方法,分析第B组实验甲中气球为比乙中气球体积大的原因__________。用离子方程式表示第B组乙中气球又缩小的原因:______________。
【题目】(14分)某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
① | 4 | B= | 10 | 30 |
② | 5 | 60 | 10 | d= |
③ | a= | 60 | c= | 20 |
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
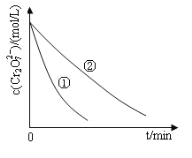
(2)上述反应后草酸被氧化为 (填化学式);
(3)实验①和②的结果表明_______________________________;
(4)该课题组对铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二: ;假设三: ;……
(5)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后, 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
(6)铁明矾长期存放,其中的亚铁离子可能会变质。为测定铁明矾中亚铁离子的质量分数。取5.6g铁明矾晶体,将其配制为100ml的溶液,取出20ml置于锥形瓶中。用0.01mol/L的标准KMnO4溶液进行滴定(还原产物为Mn2+),平行做4组实验,得出如下表数值。
组数 | 1 | 2 | 3 | 4 |
消耗V(KMnO4)/ml | 20.04 | 20.00 | 18.90 | 19.96 |
请计算铁明矾中亚铁离子的质量分数: 。若滴定结束后读数时仰视,测定结果 (填“偏大”“不影响”或“偏小”)