题目内容
【题目】铁元素是重要的金属元素,铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素具有氧化性也有还原性的物质是_________。
a.铁单质 b.氯化亚铁 c.铁红 d.Fe3O4
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO42-、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:____ Fe(OH)3+___ ClO-+_______=____FeO42-+____Cl-+______
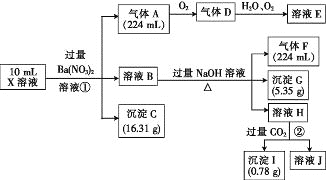
(3)电子工业上用氯化铁腐蚀铜箔,制造印刷电路板,并从使用过的腐蚀废液(含有FeCl2、CuCl2、FeCl3)中回收铜,并获得氯化铁晶体,其工艺流程如下:回答下列问题:
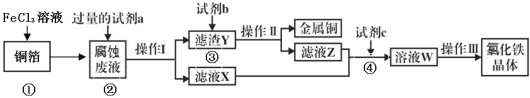
①反应①的化学方程式:_______________;
②从反应①和②可以判断出Fe2+、Cu2+、Fe3+的氧化性从强到弱顺序为:____________;
③操作I用到的玻璃仪器有烧杯、玻璃棒和___________;
④滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为:___________________。
【答案】BD 2 3 4OH- 2 3 5H2O 2FeCl3+Cu═2FeCl2+CuCl2 Fe3+>Cu2+>Fe2+ 漏斗 2Fe2++Cl2═2Fe3++2Cl-
【解析】
腐蚀液中含有FeCl2、CuCl2,分离难溶性固体和溶液采用过滤方法,所以操作I为过滤;向腐蚀液中加入过量的试剂a,得到滤渣Y和滤液X,加入的a为Fe,滤渣Y为Cu、Fe,滤液X为FeCl2,向滤渣Y中加入试剂b为稀盐酸,然后过滤得到Cu和滤液Z,Z中含有FeCl2和过量稀盐酸,然后加入试剂c,应该加入氯水,将FeCl2氧化为FeCl3,最后将溶液W蒸发浓缩、冷却结晶、过滤得到氯化铁晶体,以此解答。
(1)铁单质是0价;氯化亚铁是二价铁;铁红是三价铁;Fe3O4 既有三价铁也有二价铁;铁元素具有氧化性也有还原性的物质中,铁元素的化合价是中间价态,正确答案是BD;
(2)Fe(OH)3中铁是+3价,K2FeO4中铁元素是+6价,制备K2FeO4需要和氧化剂ClO-反应,根据得失电子守恒和原子守恒可以配平方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O ;
(3)①反应①中FeCl3和铜反应生成氯化亚铁和氯化铜,方程式为:2FeCl3+Cu═2FeCl2+CuCl2;
②反应①2FeCl3+Cu═2FeCl2+CuCl2中Fe3+是氧化剂,Cu2+是氧化产物,则氧化性:Fe3+>Cu2+;反应②为Fe+ Cu2+= Fe2++Cu,该反应中Cu2+是氧化剂,Fe2+是氧化产物,则氧化性: Cu2+>Fe2+,Fe2+、Cu2+、Fe3+的氧化性从强到弱顺序为:Fe3+>Cu2+>Fe2+;
③操作I为过滤,用到的玻璃仪器有烧杯、玻璃棒和漏斗;
④由分析可知滤液X、Z中都有同一种溶质FeCl2,应该加入氯水,将FeCl2氧化为FeCl3,离子方程式为:2Fe2++Cl2═2Fe3++2Cl-。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】如图为碳元素的价类二维图,结合图中的物质部分转化关系,完成下列问题:
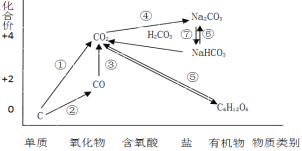
(1)下列说法正确的是 __________
a.要实现反应①一定要与氧化剂作用
b.要实现反应②一定要与还原剂作用
c.在一定条件下木炭与浓硝酸能实现 反应①转化
d.反应⑤属于非氧化还原反应
(2)下列有关碳及其化合物类别及性质说法不正确的是__________
a.CO不属于酸性氧化物,具有还原性
b.CO2属于酸性氧化物,可以与碱反应生成碳酸盐
c.NaHCO3属于弱酸的酸式盐,既能与硫酸反应又能与NaOH反应
d.金刚石和石墨互为同素异形体,其物理性质和化学性质均相同
(3)高炉炼铁的过程是将铁矿石(Fe2O3)还原成金属铁的过程,实现了反应③的转化,请写出其反应的化学方程式,并用“双线桥”表示电子的得失情况______________________________ 。
(4)化学活动课上,两组同学分别用如图所示甲、乙两装置探究“Na2CO3、NaHCO3与稀盐酸的反应”。按下表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。请回答:
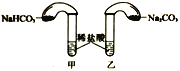
①两组反应开始时,装置___________(填“甲”或“乙”)中的气球体积先变大,该装置中反应的离子方程式是______________________。
②当试管中不再有气体生成时,两组实验出现不同现象。
试剂用量 | 实验现象 | 分析原因 | |
第A组 | 0.84gNaHCO3 1.06gNa2CO3 6ml 4mol·L-1盐酸 | 甲中气球与乙中气球的 体积相等 | 甲、乙盐酸均过量 n(NaHCO3)= n(Na2CO3) V(CO2)甲=V(CO2)乙 |
第B组 | 1.2gNaHCO3 1.2gNa2CO3 6ml 2mol·L-1盐酸 | 甲中气球比乙中气球的体积大 片刻后,乙中气球又缩小,甲中气球的体积基本不变 |
|
按上表第A组原因分析方法,分析第B组实验甲中气球为比乙中气球体积大的原因__________。用离子方程式表示第B组乙中气球又缩小的原因:______________。