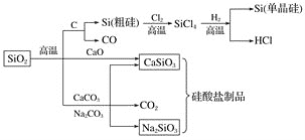
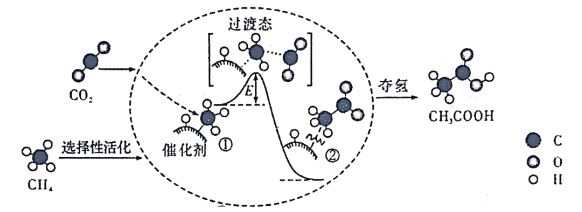
题目内容
【题目】Ⅰ.氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。请回答:

(1)实验室制取氨气的化学方程式是____。
(2)如图一是进行氨气喷泉实验的装置,引发喷泉后氨气使烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)____。
(3)该小组同学设计了如图二所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。
①实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式___。
②碱石灰的作用是________。
③该装置存在明显缺陷,请指出存在的问题______。
Ⅱ.3.2g Cu与30mL,8mol/L过量HNO3反应,硝酸的还原产物为NO,NO2,反应后溶液中所含H+为a mol,则:①此时溶液中所含的NO![]() 为_____ mol。
为_____ mol。
②所生成的NO在标准状况下体积为_______L。(以上结果均用含a的代数式表示)
【答案】2NH4Cl + Ca(OH)2![]() CaCl2 + 2NH3↑+2H2O NH3 + H2O
CaCl2 + 2NH3↑+2H2O NH3 + H2O![]() NH3·H2O
NH3·H2O![]() NH
NH![]() + OH- 3CuO + 2NH3
+ OH- 3CuO + 2NH3![]() 3Cu + N2 + 3H2O 吸收氨气中有的水蒸气,防止干扰产物水的测定。 此装置没有尾气吸收装置,NH3排入大气,污染环境 (0.1+a) 11.2(a-0.04)
3Cu + N2 + 3H2O 吸收氨气中有的水蒸气,防止干扰产物水的测定。 此装置没有尾气吸收装置,NH3排入大气,污染环境 (0.1+a) 11.2(a-0.04)
【解析】
I.(1)在加热条件下,氯化铵和氢氧化钙反应生成氯化钙、氨气和水,化学方程式:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(2)氨气与水反应生成一水合氨,一水合氨为弱碱,部分电离生成氨根离子和氢氧根离子,溶液呈碱性,遇酚酞呈现红色,离子方程式:NH3+H2O![]() NH3H2O
NH3H2O![]() NH4++OH-;答案为:NH3+H2O
NH4++OH-;答案为:NH3+H2O![]() NH3H2O
NH3H2O![]() NH4++OH-。
NH4++OH-。
(3)①黑色CuO变为红色,红色是铜,所以生成物是铜;白色无水CuSO4粉末变为蓝色生成五水合硫酸铜,说明生成物含有水;同时生成一种无色气体,该气体无污染,由元素守恒可知为N2,则可判断氨气与氧化铜在加热条件下发生氧化还原反应,化学方程式为:3CuO+2NH3![]() 3Cu+N2↑+3H2O;答案为:3CuO+2NH3
3Cu+N2↑+3H2O;答案为:3CuO+2NH3![]() 3Cu+N2↑+3H2O。
3Cu+N2↑+3H2O。
②碱石灰是干燥剂,能吸收水蒸气,防止干扰产物水的测定;答案为吸收氨气中混有的水蒸气,防止干扰产物水的测定。
③氨气是刺激性气体,所以不能排入空气,应有尾气处理装置;答案为此装置没有尾气吸收装置,NH3排入大气,污染环境。
Ⅱ.①3.2gCu的物质的量为n(Cu)=3.2g÷64g/mol=0.05mol,与HNO3反应后,生成Cu(NO3)2,由Cu元素守恒,则Cu(NO3)2的物质的量也为0.05mol,根据Cu(NO3)2 =Cu2++2NO3-,可知Cu(NO3)2中含NO3-为0.05×2=0.1mol,又反应后溶液中所含H+为a mol ,由HNO3═H++NO3-可知,HNO3中含NO3-为amol,则此时溶液中含有NO3-的物质的量为(0.1+a )mol;答案为(0.1+a )。
②浓硝酸与铜反应生成NO2,随着反应的进行,硝酸的浓度逐渐降低,则生成NO,反应后溶液中硝酸过量,n(NO3-)=(0.1+a)mol,加入的30mL,8mol/L过量HNO3,n(HNO3)=0.03L×8mol/L=0.24mol,设混合气体中NO的物质的量为x,NO2的物质的量为y,由N元素守恒可知,x+y=0.24-(0.1+a),根据电子守恒可得:3x+y=2×0.05 ,解之得:x=![]() (a-0.04)mol,标况下V(NO)=
(a-0.04)mol,标况下V(NO)=![]() (a-0.04)mol ×22.4L/mol=11.2(a-0.04)L;答案为11.2(a-0.04)。
(a-0.04)mol ×22.4L/mol=11.2(a-0.04)L;答案为11.2(a-0.04)。