题目内容
【题目】以硫铁矿(主要成分为FeS2)为原料制备硫酸亚铁晶体(FeSO4·7H2O)的工艺流程如下:
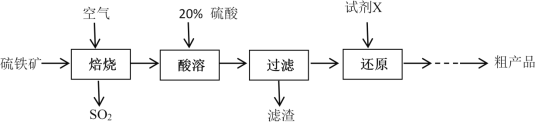
回答下列问题:
(1)焙烧后得到的固体主要成分为Fe2O3。写出焙烧过程主要反应的化学方程式____________________
(2)试剂X是(写化学式)__________________
(3)设计实验检验还原得到的溶液是否达标:_________________________________________
(4)从还原得到的溶液中获得硫酸亚铁晶体(FeSO4·7H2O)的操作是_______________________
(5)可以用标准浓度的酸性KMnO4溶液来测定产品中FeSO4的纯度,反应中KMnO4被还原成Mn2+。反应的离子方程式为 __________________________________
(6)某种工业品中含有FeSO4和Fe2(SO4)3。通过元素分析得知其中铁元素和硫元素的物质的量之比n(Fe)︰n(S) =1︰1.2 ,此工业品中FeSO4的物质的量分数为___________________________
【答案】4FeS2 + 11O2 ![]() 2Fe2O3 + 8SO2 Fe 取少量溶液于试管中,滴加KSCN溶液,如果溶液不显红色,证明溶液达标 蒸发浓缩、冷却结晶、过滤 MnO4- + 5Fe2+ +8 H+ = Mn2+ + 5Fe3++ 4H2O 3/4 (75%)
2Fe2O3 + 8SO2 Fe 取少量溶液于试管中,滴加KSCN溶液,如果溶液不显红色,证明溶液达标 蒸发浓缩、冷却结晶、过滤 MnO4- + 5Fe2+ +8 H+ = Mn2+ + 5Fe3++ 4H2O 3/4 (75%)
【解析】
硫铁矿通入空气焙烧得到氧化铁和二氧化硫,固体物质加入20%硫酸酸溶后过滤后得到溶液为硫酸铁溶液,硫酸铁中加入铁粉得到硫酸亚铁溶液,经蒸发浓缩、冷却结晶得到硫酸亚铁晶体,据此答题。
(1)硫铁矿高温焙烧反应生成氧化铁和二氧化硫,原子守恒配平书写化学方程式为4FeS2+11O2![]() 2Fe2O3+8SO2,故答案为:4FeS2+11O2
2Fe2O3+8SO2,故答案为:4FeS2+11O2![]() 2Fe2O3+8SO2。
2Fe2O3+8SO2。
(2)由分析可知,加入的试剂X是铁,铁与硫酸铁反应生成硫酸亚铁,故答案为:Fe。
(3)检验还原得到的溶液是否达标就是看溶液中是否含有铁离子,用KSCN溶液检验是否含有Fe3+,具体操作为:取少量溶液于试管中,滴加KSCN溶液,如果溶液不显红色,证明溶液达标,故答案为:取少量溶液于试管中,滴加KSCN溶液,如果溶液不显红色,证明溶液达标。
(4)从还原得到的溶液中获得硫酸亚铁晶体(FeSO4·7H2O)的操作是蒸发浓缩、冷却结晶、过滤,故答案为:蒸发浓缩、冷却结晶、过滤。
(5)高锰酸钾在酸性溶液中具有强氧化性能氧化亚铁离子为铁离子,本身被还原为二价锰离子,铁元素的化合价由+2价升高为+3价,锰元素的化合价由+7价降低为+2价,根据电荷守恒和原子守恒,反应的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
(6)设某种工业品中含有FeSO4的物质的量为xmol,Fe2(SO4)3的物质的量为ymol,根据铁元素和硫元素的物质的量之比n(Fe)︰n(S) =1︰1.2可知,(x+2y):(x+3y)=1:1.2,解得x:y=3:1,所以FeSO4的物质的量分数为3/(3+1)×100%=75%,故答案为:3/4(75%)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案