题目内容
【题目】根据所学电化学知识,回答有关问题。
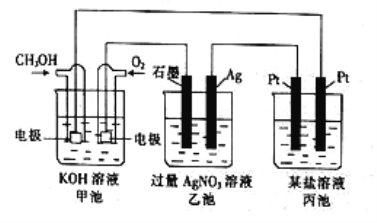
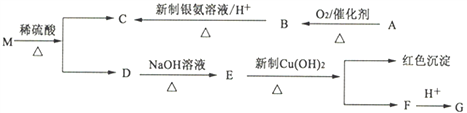
(1)图中甲池是____(填“原电池”或“电解池”)装置,其中OH-移向___(填“正”或“负”)极。
(2)通入CH3OH一端的电极反应式为_____________________。
(3)反应一段时间后,甲池中消耗560mL(标准状况)O2,此时乙池溶液的pH=______(设此时乙池中溶液的体积为100mL)。
(4)当乙池中Ag电极的质量增加5.4g时,丙池中某电极析出1.6g某金属,则丙池中的某盐可能是__________(填字母)。
A.MgSO4 B.CuCl2 C.NaCl D.AgNO3
【答案】 原电池 负 CH3OH-6e-+8OH-==CO32-+6H2O 0 BD
【解析】分析:(1)甲池是能自发的进行氧化还原反应,属于原电池,据此解答;
(2)燃料电池的负极上是燃料发生失电子的氧化反应;
(3)根据电子守恒来计算;
(4)根据电解池的工作原理结合电子守恒来计算即可。
详解:(1)图中甲池能自发进行氧化还原反应,属于原电池中的燃料电池;原电池中阳离子向正极移向,阴离子向负极移动。通入甲醇的电极是负极,因此OH-移向负极;
(2)通入CH3OH的电极是燃料电池的负极,发生失电子的氧化反应,电解质溶液显碱性,则负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
(3)标准状况下560mL氧气的物质的量是0.56L÷22.4L/mol=0.025mol,转移0.025mol×4=0.1mol电子。电解池中连接原电池负极的电极为阴极、连接原电池正极的电极为阳极,因此石墨是阳极,银电极是阴极,电解硝酸银溶液的方程式为4AgNO3+2H2O![]() 4Ag+4HNO3+O2↑,即产生4mol硝酸,转移4mol电子,所以反应中生成0.1mol硝酸,物质的量浓度是0.1mol÷0.1L=1.0mol/L,则此时乙池溶液的pH=0。
4Ag+4HNO3+O2↑,即产生4mol硝酸,转移4mol电子,所以反应中生成0.1mol硝酸,物质的量浓度是0.1mol÷0.1L=1.0mol/L,则此时乙池溶液的pH=0。
(4)根据电解池的工作原理,电解硝酸银溶液的反应为4AgNO3+2H2O![]() 4Ag+4HNO3+O2↑,当乙池中Ag极质量增加5.4g,根据电极反应Ag++e-=Ag,生成0.05mol银,转移电子是0.05mol,此时丙池中某电极析出1.6g某金属,则该金属是铜(氯化铜恰好反应或过量),也可以是析出金属银的情况(硝酸银不足),镁离子和钠离子在水溶液中不会放电,答案选BD。
4Ag+4HNO3+O2↑,当乙池中Ag极质量增加5.4g,根据电极反应Ag++e-=Ag,生成0.05mol银,转移电子是0.05mol,此时丙池中某电极析出1.6g某金属,则该金属是铜(氯化铜恰好反应或过量),也可以是析出金属银的情况(硝酸银不足),镁离子和钠离子在水溶液中不会放电,答案选BD。

【题目】25℃,几种物质的pH和浓度如下表所示。
序号 | ① | ② | ③ | ④ |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
pH | 11 | 11 | 3 | 3 |
浓度 | c1 | c2 | c3 | c4 |
回答下列问题:
(1) c1_____(填“>”“<”或“=”) c2。
(2)溶液中水的电离程度②_____(填“>”“<”或“=”)③。
(3)分别加水稀释10倍,稀释后四种溶液的pH由大到小的顺序为________(填序号)。
(4) ①溶液与④溶液等体积混合,溶液的pH_______(填“>"'<"或“=”,下同)7,混合溶液中c(NH4+)____c(Cl-)。