题目内容
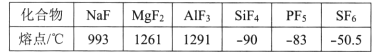
【题目】在1L密闭容器中通入2mol氨气,在一定温度下,发生下列反应:2NH3 ![]() N2+3H2,达到平衡时,容器内N2的百分含量为a%,若维持容器的体积和温度都不变,分别通入下列几组物质,达到平衡时,容器内N2的含量仍为a%的是( )
N2+3H2,达到平衡时,容器内N2的百分含量为a%,若维持容器的体积和温度都不变,分别通入下列几组物质,达到平衡时,容器内N2的含量仍为a%的是( )
A.3molH2和1molN2B.2molNH3和1molN2
C.2molN2和3molH2D.0.1molNH3,0.95molN2和2.85molH2
【答案】AD
【解析】
反应2NH33H2+N2,在恒温恒容下,达到平衡时,容器内N2的百分含量也为a%,说明与原平衡是等效平衡,按化学计量数转化到方程式的左边,满足n(NH3)=2mol即可,据此进行分析。
根据等效平衡,按化学计量数转化到方程式的左边,满足n(NH3)=2mol,则达到平衡时,容器内N2的百分含量为a%,
A.3molH2+1molN2按化学计量数转化到方程式的左边可得:n(NH3)=2mol,与初始量2molNH3相同,属于等效平衡,故A符合题意;
B.2molNH3+1molN2与初始量2molNH3不相同,则不属于等效平衡,达到平衡时,容器内N2的百分含量不是a%,故B不符合题意;
C.2molN2+3molH2按化学计量数转化到方程式的左边,可得:n(NH3)=2mol、n(N2)=1mol,与初始加入物质不同,不是等效平衡,故C不符合题意;
D.0.1molNH3+0.95molN2+2.85molH2,按化学计量数转化到方程式的左边可得:n(NH3)=2mol,与初始量2molNH3相同,属于等效平衡,故D符合题意;
答案选AD。

【题目】下面是丁醇的两种同分异构体,其结构简式、沸点及熔点如下表所示:
异丁醇 | 叔丁醇 | |
结构简式 |
|
|
沸点/℃ | 108 | 82.3 |
熔点/℃ | -108 | 25.5 |
下列说法不正确的是
A. 用系统命名法给异丁醇命名为:2-甲基-1-丙醇
B. 异丁醇的核磁共振氢谱有三组峰,且面积之比是1∶2∶6
C. 用蒸馏的方法可将叔丁醇从二者的混合物中分离出来
D. 两种醇发生消去反应后得到同一种烯烃
【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、Al2O3等杂质。工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
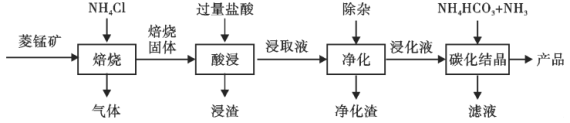
已知:MnCO3+2NH4Cl=MnCl2+CO2↑+2NH3↑+H2O.
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 |
(1)焙烧时温度对锰浸取率的影响如图。焙烧时适宜的温度为___________左右;800℃以上锰的浸取率偏低,可能的原因是___________。
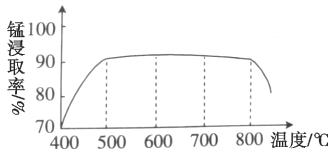
(2)净化包含三步:①加入少量MnO2,添加少量MnO2的作用是____________。发生反应的离子方程式为___________。
②加氨水调pH,溶液的pH范围应调节为___________~8.1之间。生成的沉淀主要是___________。
③加入MnF2,沉淀除去Ca2+,若溶液酸度过高,Ca2+沉淀不完全,原因是___________。
(3)碳化结晶中生成MnCO3的离子方程式为____________。