题目内容
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(l)氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O>___。基态K+电子占据最高能级的电子云轮廓图为___形。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是___,中心原子的杂化形式为___。NaBH4中存在___(填标号)。
a.离子键 b.氢键 c.![]() 键 d.
键 d.![]() 键
键
(3)BeC12中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为___,其中Be的配位数为___。
(4)第三周期元素氟化物的熔点如下表:
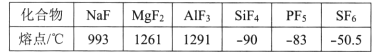
解释表中氟化物SiF4 、PF5、SF6熔点变化的原因:___。
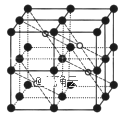
(5)CaF2的一种晶胞如图所示。若r(F-)=xpm,r(Ca2+) =ypm,设阿伏加德罗常数的值为NA,则CaF2的密度![]() =___g·cm-3(列出计算表达式)。
=___g·cm-3(列出计算表达式)。
【答案】Be>B>K 哑铃 正四面体 sp3 ac ![]() 3 SiF4 、PF5、SF6均属于分子化合物,且分子间均无氢键,其范德华力(或分子间作用力)逐渐增加
3 SiF4 、PF5、SF6均属于分子化合物,且分子间均无氢键,其范德华力(或分子间作用力)逐渐增加 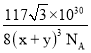
【解析】
(1)氟代硼酸钾(KBe2BO3F2)中含有元素K、Be、B、O、F,根据同周期元素第一电离能逐渐增大的趋势以及全满半满导致反常可知,第一电离能大小关系为:F>O>Be>B>K,基态K+最高能级符号为3p,其电子云轮廓图为哑铃形,
故答案为:Be>B>K;哑铃;
(2)NaBH4中阴离子为BH4-,其成键电子对为4,孤电子对为![]() =0
=0
,故其空间构型为正四面体,其中心原子杂化形式为sp3,NaBH4为离子化合物,含有离子键,其阴离子中化学键全部为单键,即全部为![]() 键,不含有氢键和
键,不含有氢键和![]() 键,因此选ac,
键,因此选ac,
故答案为:正四面体;sp3;ac;
(3)BeC12的双聚分子为Be2Cl4,其结构式为:![]() ,由其结构式可知,Be的配位数为3,
,由其结构式可知,Be的配位数为3,
故答案为:![]() ;3;
;3;
(4)SiF4 、PF5、SF6均属于分子化合物,且分子间均无氢键,其范德华力逐渐增加,其熔点逐渐升高,
故答案为:SiF4 、PF5、SF6均属于分子化合物,且分子间均无氢键,其范德华力(或分子间作用力)逐渐增加;
(5)该晶胞中黑球个数为:![]() =8,白球个数为4,故一个晶胞中含有4个CaF2“分子”,该晶胞的质量为:
=8,白球个数为4,故一个晶胞中含有4个CaF2“分子”,该晶胞的质量为:![]() g,设该晶胞边长为acm,该晶胞的体对角线为
g,设该晶胞边长为acm,该晶胞的体对角线为![]() a=4×(x+y)×10-10cm,解得a=
a=4×(x+y)×10-10cm,解得a=![]() cm,该晶胞密度
cm,该晶胞密度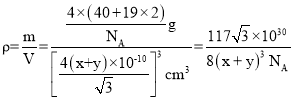 g·cm-3,
g·cm-3,
故答案为: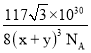 。
。

【题目】已知![]() 、
、![]() 、
、![]() 均为主族元素,分析表中数据,判断下列说法正确的是(
均为主族元素,分析表中数据,判断下列说法正确的是(![]() )( )
)( )
元素 |
|
|
|
最外层电子数 |
| b | a |
原子半径/ | 0.152 | 0.143 | 0.186 |
A.![]() 与
与![]() 位于同一主族,且
位于同一主族,且![]() 在
在![]() 的上一周期
的上一周期
B.![]() 与
与![]() 位于同一主族,且
位于同一主族,且![]() 在
在![]() 的下一周期
的下一周期
C.![]() 与
与![]() 位于同一周期,且
位于同一周期,且![]() 的原子序数小于
的原子序数小于![]() 的原子序数
的原子序数
D.![]() 与
与![]() 位于同一主族,且
位于同一主族,且![]() 的原子序数小于
的原子序数小于![]() 的原子序数
的原子序数