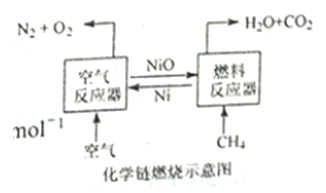
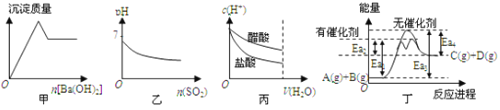
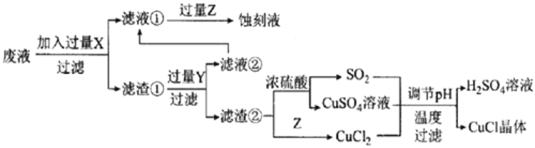
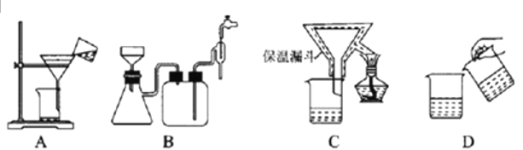
题目内容
【题目】氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.001 mol·L-1KMnO4酸性溶液滴定未知浓度的无色NaHSO3溶液。反应的离子方程式是2MnO![]() +5HSO
+5HSO![]() +H+=2Mn2++5SO42-+3H2O
+H+=2Mn2++5SO42-+3H2O
填空完成问题:
(1)该滴定实验所需仪器有下列中的____________。
A酸式滴定管(50 mL) B碱式滴定管(50 mL) C量筒(10 mL) D锥形瓶 E铁架台
F滴定管夹 G烧杯 H白纸 I胶头滴管 J漏斗
(2)不能用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因________________。
(3)选何种指示剂,说明理由____________________________。
(4)滴定前平视KMnO4溶液液面,刻度为a mL,滴定后俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积________(填“多”或“少”)。根据(b-a)mL计算得到的待测浓度,比实际浓度________(填“大”或“小”)。
【答案】(1)ADEFH;(2)碱,高锰酸钾能腐蚀橡胶管且通常要酸化;(3)不用指示剂,因为MnO![]() →Mn2+时紫色褪去;(4)少,小。
→Mn2+时紫色褪去;(4)少,小。
【解析】
(1)根据中和滴定的实验步骤,可以知道使用的实验仪器有:ADEFH;
(2)酸性高锰酸钾具有强氧化性,能腐蚀橡胶,因此用酸式滴定管盛放酸性高锰酸钾溶液,酸式滴定管不能盛放碱性溶液,碱式滴定管不能盛放酸性溶液和具有强氧化性的溶液;
(3)酸性高锰酸钾呈现紫红色,在滴定中会出现颜色变化,因此不用指示剂;
(4)滴定管从上到下刻度增大,滴定后俯视液面,比实际消耗高锰酸钾溶液体积少,根据反应方程式,得出:c(HSO3-)=(b-a)×10-3×0.001×5/2V×10-3mol·L-1,(b-a)减小,所测浓度会偏小。