题目内容
8.用括号中的试剂除去各组中的杂质,正确的是( )| A. | 苯中的甲苯(溴水) | B. | 95.6%乙醇中的水(CaO) | ||
| C. | 乙烷中的乙烯(酸性高锰酸钾) | D. | 溴苯中的溴(苯) |
分析 A.溴易溶于苯;
B.CaO与水反应后,增大与乙醇的沸点差异;
C.乙烯被高锰酸钾氧化后生成二氧化碳;
D.溴、溴苯均易溶于苯.
解答 解:A.溴易溶于苯,引入新杂质,应选高锰酸钾、分液除杂,故A错误;
B.CaO与水反应后,增大与乙醇的沸点差异,则加CaO后蒸馏可除杂,故B正确;
C.乙烯被高锰酸钾氧化后生成二氧化碳,引入新杂质,应选溴水、洗气除杂,故C错误;
D.溴、溴苯均易溶于苯,不能除杂,应选NaOH溶液、分液除杂,故D错误;
故选B.
点评 本题考查物质的分离提纯的方法及选择,为高频考点,把握有机物的性质、性质差异及除杂的原则为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
18.研究人员最近发现了一种“水电池”,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池总反应式为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,下列对“水电池”在海水中放电时的有关说法正确的是( )
| A. | 正极反应式为:5MnO2+2e-═Mn5O102- | |
| B. | 每生成1 mol AgCl转移2 mol电子 | |
| C. | 工作时,电子由MnO2极经外电路流向Ag极 | |
| D. | Ag发生还原反应 |
19.图表法是常用的科学研究方法.下表①~⑩所代表的元素均在元素周期表的前20号.它们的主要化合价如表所示.
(1)元素②在周期表中的位置是第二周期第ⅤⅡA族,元素⑥的离子结构示意图
(2)元素⑦的最高价氧化物对应水化物的化学式是H2SiO3,元素①和⑧形成的化合物其化学键是离子键,(填“共价键”或“离子键”).元素①和③形成的化合物有H2O、H2O2,属于共价化合物(填“共价”或“离子”).
(3)这些元素中金属性最强的是K(填元素符号),气态氢化物最稳定的是HF(填氢化物化学式).
(4)写出一种由上述元素中的非金属元素组成的离子化合物化学式NH4NO3.
(5)由上述某些元素组成的物质A、B、C、D有如下转化关系:A$?_{D}^{C}$B
如果A是一种红棕色气体,D是一种黑色的固体单质,则B的化学式为HNO3,B与D反应生成A的化学方程式为C+4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
| 代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 半径(pm) | 30 | 64 | 66 | 91 | 70 | 106 | 110 | 186 | 125 | 232 |
| 主要 化合价 | -1,+1 | -1 | -2 | -4, +4 | -3, +5 | -2,+4,+6 | -4, +4 | +1 | +3 | +1 |

(2)元素⑦的最高价氧化物对应水化物的化学式是H2SiO3,元素①和⑧形成的化合物其化学键是离子键,(填“共价键”或“离子键”).元素①和③形成的化合物有H2O、H2O2,属于共价化合物(填“共价”或“离子”).
(3)这些元素中金属性最强的是K(填元素符号),气态氢化物最稳定的是HF(填氢化物化学式).
(4)写出一种由上述元素中的非金属元素组成的离子化合物化学式NH4NO3.
(5)由上述某些元素组成的物质A、B、C、D有如下转化关系:A$?_{D}^{C}$B
如果A是一种红棕色气体,D是一种黑色的固体单质,则B的化学式为HNO3,B与D反应生成A的化学方程式为C+4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
16.反应X(g)+Y(g)?2Z(g)△H<0,达到平衡时,下列说法正确的是( )
| A. | 增大c(X),X的转化率增大 | B. | 降低温度,Y的转化率增大 | ||
| C. | 减小容器体积,平衡向右移动 | D. | 加入催化剂,Z的产率增大 |
3.已知反应M+N=X+Y为吸热反应,对这个反应的下列说法正确的是( )
| A. | M的能量一定低于X的,N的能量一定低于Y的 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中化学键吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | M和N的总能量一定低于X和Y的总能量 |
2.下列气体中,不能用排空气法收集的是( )
| A. | NO | B. | SO2 | C. | CO2 | D. | NO2 |
3.环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义
(Ⅰ)工业生产中已知3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H=-49.5KJ/mol
H2(g)+CO2(g)?CO(g)+H2O (g)△H=+41.3KJ/mol
(1)写出由H2 和CO 制 CH3OH 的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol
(2)H2 和CO 能自发反应生成CH3OH的条件是低温
(3)某温度下(1)中的平衡常数为1.2,能使平衡常数变为2的下列条件有D
A.增大压强 B.增大CO的浓度 C.升高温度 D.降低温度 E.使用催化剂
(4)在一定温度下密闭容器中,按H2与CO2体积比3:1进行投料,3H2+CO2?CH3OH+H2O 反应达到平衡的标志有BC
A.平衡常数不变 B.CO2的转化率不变
C.混和气体的平均相对分子质量不再改变 D.混合气体的密度不变
(Ⅱ) 将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)fCO2(g)+H2(g)△H,得到如下数据:
(1)650℃时,若在此容器中开始充入2molH2O(g)、lmolCO、1molCO2和2molH2,则反应在开始时正向进行(填“正向”或“逆向”).
(2)达平衡时实验Ⅱ和实验Ⅲ中H2O(g)的转化率的大小关系为:a2(HO)>a3(H2O)(填“>”、“<”或“=”).
(Ⅲ) 一定条件下反应:6H2(g)+2CO2(g)?C2H5OH (g)+3H2O(g)△H它的有关数据如图1所示.
(1)下列说法正确的是C
A.曲线Ⅰ对应的反应物起始物质的量为1.5 B.达平衡时,v(H2)正=v(CO2)逆
C.a点对应的H2的平衡转化率为90% D.b点对应的平衡常数K值大于c点
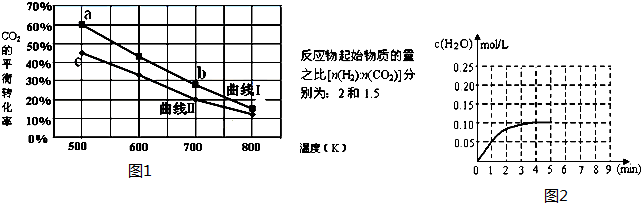
(2)温度为T1时CO(g)+H2O(g)?H2(g)+CO2(g),在体积为2升的密闭 容器中加入0.4molCO2和0.4mol H2,第4分钟达到平衡,反应中H2O的浓度变化情况如图所示,在第5分钟时向体系中再充入0.2molCO2和0.2mol H2,(其它条件不变),第8分钟达平衡,请在图2中画出5到9分钟的H2O的浓度变化曲线.
(Ⅰ)工业生产中已知3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H=-49.5KJ/mol
H2(g)+CO2(g)?CO(g)+H2O (g)△H=+41.3KJ/mol
(1)写出由H2 和CO 制 CH3OH 的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol
(2)H2 和CO 能自发反应生成CH3OH的条件是低温
(3)某温度下(1)中的平衡常数为1.2,能使平衡常数变为2的下列条件有D
A.增大压强 B.增大CO的浓度 C.升高温度 D.降低温度 E.使用催化剂
(4)在一定温度下密闭容器中,按H2与CO2体积比3:1进行投料,3H2+CO2?CH3OH+H2O 反应达到平衡的标志有BC
A.平衡常数不变 B.CO2的转化率不变
C.混和气体的平均相对分子质量不再改变 D.混合气体的密度不变
(Ⅱ) 将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)fCO2(g)+H2(g)△H,得到如下数据:
| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| I | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| II | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| III | 900 | 2 | 1 | a | b | t |
(2)达平衡时实验Ⅱ和实验Ⅲ中H2O(g)的转化率的大小关系为:a2(HO)>a3(H2O)(填“>”、“<”或“=”).
(Ⅲ) 一定条件下反应:6H2(g)+2CO2(g)?C2H5OH (g)+3H2O(g)△H它的有关数据如图1所示.
(1)下列说法正确的是C
A.曲线Ⅰ对应的反应物起始物质的量为1.5 B.达平衡时,v(H2)正=v(CO2)逆
C.a点对应的H2的平衡转化率为90% D.b点对应的平衡常数K值大于c点

(2)温度为T1时CO(g)+H2O(g)?H2(g)+CO2(g),在体积为2升的密闭 容器中加入0.4molCO2和0.4mol H2,第4分钟达到平衡,反应中H2O的浓度变化情况如图所示,在第5分钟时向体系中再充入0.2molCO2和0.2mol H2,(其它条件不变),第8分钟达平衡,请在图2中画出5到9分钟的H2O的浓度变化曲线.
 .
.

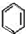 生成
生成 的反应类型是取代反应.
的反应类型是取代反应.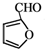 .
. .
.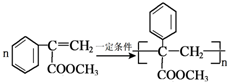 .
.