题目内容
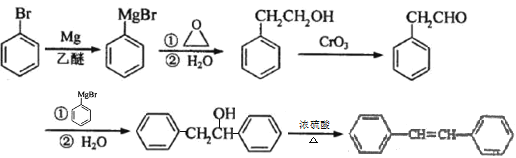
【题目】化合物J是一种重要的有机中间体,可以由苯合成,具体合成路线如下:

已知:醛或酮与锌汞齐(Zn-Hg)在浓盐酸条件下发生如下反应,称为Clemmensen反应

(1)请举出工业上获得原料A的来源:_________________________________________。
(2)B催化氢化得Z(C10H12O3),写出Z在一定条件下聚合反应的化学方程式:___________。
(3)请写出![]() 的化学方程式:________________,D中官能团名称是____________。
的化学方程式:________________,D中官能团名称是____________。
(4)Clemmensen反应的可能机理是:锌汞齐在浓盐酸的介质中形成原电池,其中锌为__________(填“正极”或“负极”),请写出D在汞电极上生成E的电极反应方程式:____________________。
(5)![]() 的反应类型为_____________。
的反应类型为_____________。
(6)I分子中最多有_______个原子共平面。与I属于同种类型物质且苯环上有两个取代基的同分异构体有_____________种。
(7)符合下列条件的J的一种同分异构体结构简式为______________________。
①属于芳香族化合物,②不能与金属钠反应,③有3种不同化学环境的氢原子。
(8)已知: (R表示烃基,R1、R2表示氢或烃基)。请结合题干和已知信息,选用必要的无机试剂,完成以
(R表示烃基,R1、R2表示氢或烃基)。请结合题干和已知信息,选用必要的无机试剂,完成以 、
、![]() 为原料制备
为原料制备 的合成路线图。(合成路线流程图示例见本题题干)。
的合成路线图。(合成路线流程图示例见本题题干)。
 _______________
_______________
【答案】煤的干馏(煤焦油)或石油的催化重整 n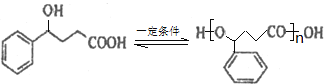 +(n-1)H2O
+(n-1)H2O  +H2O 羰基 负极
+H2O 羰基 负极  +4H++4e-
+4H++4e- +H2O 氧化反应 21 14
+H2O 氧化反应 21 14 
【解析】
由A、B的结构可知,A与![]() 发生反应生成B为
发生反应生成B为 ,B与锌汞齐(Zn-Hg)在浓盐酸条件下发生反应生成C,由已知反应及B的结构可知C的结构为
,B与锌汞齐(Zn-Hg)在浓盐酸条件下发生反应生成C,由已知反应及B的结构可知C的结构为 ![]() ,C发生反应生成D为
,C发生反应生成D为  ,D与锌汞齐(Zn-Hg)在浓盐酸条件下发生反应生成E为
,D与锌汞齐(Zn-Hg)在浓盐酸条件下发生反应生成E为![]() ,E发生去氢反应生成F为
,E发生去氢反应生成F为 ![]() ,F发生卤代反应生成G为
,F发生卤代反应生成G为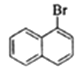 ,G与Mg在乙醚存在的条件下生成H为
,G与Mg在乙醚存在的条件下生成H为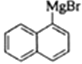 ,H与环氧乙烷反应后再水解生成I为
,H与环氧乙烷反应后再水解生成I为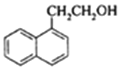 ,H被CrO3氧化得到J为
,H被CrO3氧化得到J为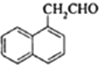 , 据此解答。
, 据此解答。
(1)A为苯,工业上用煤的干馏(煤焦油)或石油的催化重整获得苯。
故答案为:煤的干馏(煤焦油)或石油的催化重整;
(2)B催化氢化得Z,结合Z的分子式可知,该反应为羰基与氢气发生加成反应,故Z为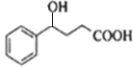 ,Z通过酯化反应进行的缩聚反应生成高聚物,该反应方程式为:
,Z通过酯化反应进行的缩聚反应生成高聚物,该反应方程式为: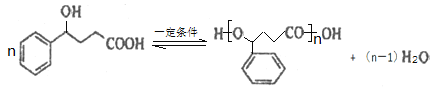 。
。
故答案为: ;
;
(3)C发生反应生成D为  ,化学方程式为:
,化学方程式为: ;由D的结构简式,可知D中官能团名称是羰基。
;由D的结构简式,可知D中官能团名称是羰基。
故答案为: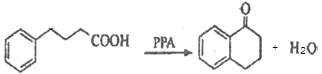 ;羰基;
;羰基;
(4)锌汞齐在浓盐酸的介质中,形成原电池,锌比汞活泼,则锌为负极,汞电极为正极,正极发生还原反应,所以 在汞电极上生成
在汞电极上生成![]() 的电极反应方程式:
的电极反应方程式: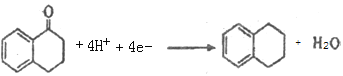 。
。
故答案为:负极;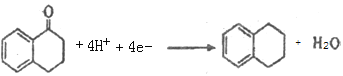 ;
;
(5)E为![]() ,E发生去氢反应生成F为
,E发生去氢反应生成F为 ![]() ,去氢属于氧化反应。
,去氢属于氧化反应。
故答案为:氧化反应;
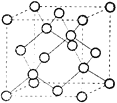
(6)I为 ,分子中苯环共平面,苯环上的碳原子以及与苯环相连的碳原子、氢原子一定在同一平面上,有18个原子;由于碳碳单键可以旋转,所以与苯环相连的碳原子相连的两个氢原子和一个碳原子(-CH2OH中的C)最多有一个原子在这个平面上,同理羟基上的O、H原子也可能在此平面上,所以最多有18+1+2=21个原子共平面。I属于芳香醇,与I属于同种类型物质且苯环上有两个取代基,则羟基不能连到苯环上,两个取代基为-CH3和-CH2OH,符合条件的同分异构体种数的根据萘环的对称性,萘环上有如图
,分子中苯环共平面,苯环上的碳原子以及与苯环相连的碳原子、氢原子一定在同一平面上,有18个原子;由于碳碳单键可以旋转,所以与苯环相连的碳原子相连的两个氢原子和一个碳原子(-CH2OH中的C)最多有一个原子在这个平面上,同理羟基上的O、H原子也可能在此平面上,所以最多有18+1+2=21个原子共平面。I属于芳香醇,与I属于同种类型物质且苯环上有两个取代基,则羟基不能连到苯环上,两个取代基为-CH3和-CH2OH,符合条件的同分异构体种数的根据萘环的对称性,萘环上有如图 中
中![]() 两种类型的氢原子,采用定一移二的方法,若-CH3在
两种类型的氢原子,采用定一移二的方法,若-CH3在![]() 位,-CH2OH可以在其它位置,共有7种结构;若-CH3在
位,-CH2OH可以在其它位置,共有7种结构;若-CH3在![]() 位,-CH2OH也在
位,-CH2OH也在![]() 位,共有3种结构;另外若-CH2OH 在
位,共有3种结构;另外若-CH2OH 在![]() 位,-CH3可以在其它位置,共有7种结构,但其中有3种与前面的重复,除此之外还有4种结构,所以符合条件的同分异构体有7+3+4=14种;
位,-CH3可以在其它位置,共有7种结构,但其中有3种与前面的重复,除此之外还有4种结构,所以符合条件的同分异构体有7+3+4=14种;
故答案为:21;14;
(7)J为 ,J的同分异构体中,①属于芳香族化合物说明含有苯环,②不能与金属钠反应说明不含羟基,③有3种不同化学环境的氢原子,由J的结构可知,分子中H原子数目很多,故该同分异构体为对称结构,不饱和度为8,可以是两个独立的苯环,另外的O原子为对称结构的连接原子,故符合条件的同分异构体的结构简式为
,J的同分异构体中,①属于芳香族化合物说明含有苯环,②不能与金属钠反应说明不含羟基,③有3种不同化学环境的氢原子,由J的结构可知,分子中H原子数目很多,故该同分异构体为对称结构,不饱和度为8,可以是两个独立的苯环,另外的O原子为对称结构的连接原子,故符合条件的同分异构体的结构简式为 。
。
故答案为: ;
;
(8)根据题干由G到J的转化条件,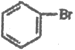 发生信息中的反应生成
发生信息中的反应生成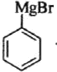 ,
, 与
与![]() 反应生成
反应生成 ,氧化后生成
,氧化后生成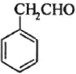 ,
, 与
与 反应转化为
反应转化为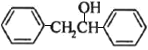 ,最后脱水得到
,最后脱水得到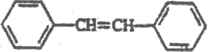 ,合成路线图为:
,合成路线图为:
 。
。
故答案为:

【题目】“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH、HCOOH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2(g)和 3molH2(g) | 1mol CH3OH (g)和 1molH2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
请回答:
①a=_______________;
②若甲中反应10 s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是___________。
(2)甲烷的一个重要用途是制取H2,其原理为CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)。在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强p1_____(填“大于”或“小于”)p2;压强为p2时,在y点:v(正)______(填“大于”“小于”或“等于”)v(逆)。
2CO(g)+2H2(g)。在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强p1_____(填“大于”或“小于”)p2;压强为p2时,在y点:v(正)______(填“大于”“小于”或“等于”)v(逆)。

(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO)∶n(CO)=2∶1的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是________(填字母)。
2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO)∶n(CO)=2∶1的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是________(填字母)。