题目内容
【题目】I.在如图装置中,用 NaOH 溶液、铁屑、稀 H2SO4 等试剂制备 Fe(OH)2。

(1)在试管Ⅰ里加入的试剂是_____;
(2)在试管Ⅱ里加入的试剂是_____;
(3)为了制得白色 Fe(OH)2 沉淀,在试管Ⅰ和Ⅱ中加入试剂后应________(填“打开”或者“关闭”)止水夹,反应一会儿后应________(填“打开”或者“关闭”)止水夹。
II.某化学兴趣小组用下图装置制取并探究氯气的性质。[A装置中发生反应的化学方程式:2KMnO4+16HCl(浓)=2KCl+2MnCl2 + 5Cl2↑+ 8H2O ]
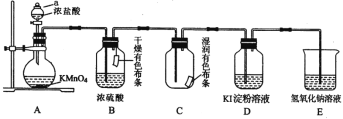
(1)A装置中a仪器的名称是_____________。
(2)实验室制氯气也可用MnO2与浓盐酸反应,化学方程式为:_____
(3)实验进行一段时间后,可观察到______(填“B”或“C”)装置中有色布条褪色,请用化学方程式表示其褪色原因__________。
(4)当氯气进入D装置后,可观察到溶液颜色变为____(填“红色”或“蓝色”),写出该反应的离子方程式为_________。
(5)E装置中反应的化学方程式为________。
(6)用31.6 g KMnO4固体与足量的浓盐酸反应,最多可生成标准状况下_____L氯气。(KMnO4的摩尔质量为158 g·mol-1)
【答案】铁屑、稀H2SO4 NaOH 溶液 打开 关闭 分液漏斗 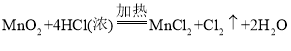 C
C ![]() 蓝色 Cl2 + 2I-=2Cl-+ I2 Cl2 + 2NaOH = NaCl + NaClO + H2O 11.2L
蓝色 Cl2 + 2I-=2Cl-+ I2 Cl2 + 2NaOH = NaCl + NaClO + H2O 11.2L
【解析】
试题Ⅰ,由于Fe(OH)2极易被氧化,所以在使用上述装置制备Fe(OH)2时,应当在Ⅰ试管中加入铁粉和稀硫酸,Ⅱ试管中加入NaOH溶液;初始阶段,打开止水夹,利用试管Ⅰ中产生的氢气对整套装置进行排气,驱赶装置内的空气和溶液中溶解的O2;一段时间后再关闭止水夹,利用Ⅰ试管中气压的逐渐增大,将含有Fe2+的溶液排入到Ⅱ试管中,这样就能制备出保存时间较长的Fe(OH)2了。
试题Ⅱ,本题利用高锰酸钾溶液与浓盐酸反应制备氯气,这个反应不需要加热,而采用浓盐酸和MnO2反应制备氯气时需要加热;由于盐酸具有挥发性,所以产生的氯气中含有杂质HCl以及水蒸气,但在本题中HCl杂质对于Cl2性质的验证并不产生干扰,所以只对其进行了干燥处理;B和C装置中的红布条一个是干燥的一个是湿润的,通过现象的对比,就可以验证Cl2漂白性来源于Cl2与水反应生成的次氯酸;D装置通过淀粉变蓝验证I2的生成,进而证明Cl2氧化性强于I2;在做完性质验证实验后,氯气仍会有部分未反应完,所以需要尾气处理装置,减少对环境的污染。
Ⅰ(1)通过分析可知,试管Ⅰ中应当加入稀硫酸和铁粉,产生氢气的同时也产生Fe2+,利用产生的氢气再配合止水夹适当地开闭,就可以实现对整套装置内残留空气的排气;
(2)通过分析可知,试管Ⅱ中加入的为NaOH溶液,即Fe(OH)2是在试管Ⅱ中反应生成的;
(3)由于Fe(OH)2极易被氧化,所以在初始阶段,打开止水夹,利用试管Ⅰ中产生的氢气对整套装置进行排气,驱赶装置内的空气和溶液中溶解的O2;一段时间后再关闭止水夹,利用Ⅰ试管中气压的逐渐增大,将含有Fe2+的溶液排入到Ⅱ试管中,这样就能制备出保存时间较长的Fe(OH)2了;
Ⅱ(1)装置A中仪器a的名称即为分液漏斗;
(2)用浓盐酸和MnO2反应制氯气的方程式为:![]() ;
;
(3)B中的红布条是干燥的,所以不会被Cl2漂白褪色,C中的红布条是湿润的所以可以被Cl2漂白褪色;Cl2的漂白性来源于与水反应生成的次氯酸,方程式为:![]() ;
;
(4)氯气的氧化性强于碘单质,所以D装置中,氯气会将碘单质置换出来,从而使装置内的淀粉变蓝;涉及的反应即为:![]() ;
;
(5)E装置为尾气吸收装置,用来除去未反应的Cl2,涉及到的化学方程式为:![]() ;
;
(6)由高锰酸钾和浓盐酸反应制取氯气的方程式可知,31.6gKMnO4即0.2mol,可以与足量的浓盐酸生成0.5mol氯气,标况下的体积即为11.2L。

 优加精卷系列答案
优加精卷系列答案